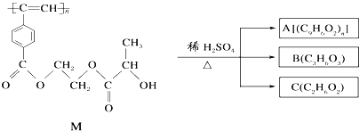
题目内容
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第IB族。Cu2+的核外电子排布式为____________。
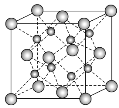
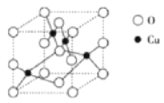
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为___________。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间结构都是三角锥形,但NF3不易与Cu2-形成配离子,其原因是__________。
(4)Cu2O的熔点比Cu2S的________(填“高”或“低”)
【答案】[Ar]3d9或1s22s22p63s23p63d9 4 F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键) 高
【解析】
(1)根据Cu的电子排布式书写Cu2+离子的电子排布式;
(2)利用均摊法分析晶胞的结构;
(3)根据电负性的角度分析;
(4)从影响离子晶体熔沸点高低的角度分析。
(1)Cu(电子排布式为:[Ar]3d104s1)形成Cu2+的过程中,参与反应的电子是最外层的4s及3d上各一个电子,故Cu2+离子的电子排布式是为:[Ar]3d9或1s22s22p63s23p63d9,
故答案为:[Ar]3d9或1s22s22p63s23p63d9;
(2)从图中可以看出阴离子在晶胞有四类:顶点(8个)、棱上(4个)、面上(2个)、体心(1个),根据立方体的分摊法,可知该晶胞中阴离子数目为:![]() ,
,
故答案为:4;
(3)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,
故答案为:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键),
(4)由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高,
故答案为:高。