题目内容
11.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )| A. | NaOH(s) | B. | CH3COONa(s) | C. | FeCl3(s) | D. | NH4Cl |
分析 减缓反应速度,应降低溶液中H+离子的浓度,不影响生成氢气的总量,则所加入物质对溶液中H+离子的总物质的量没有影响,
题目中NaOH与酸中和、NH4Cl水解呈酸性,都引起H+离子的物质的量的变化;
加氯化铁固体,对氢离子浓度无影响且不能形成原电池,加入CH3COONa生成弱酸,H+离子浓度降低,但不影响生成氢气的总量.
解答 解:A、NaOH与酸中和,引起H+离子的物质的量的变化,影响生成氢气的总量,故A错误;
B、加入CH3COONa生成弱酸,H+离子浓度降低,但H+离子的物质的量的不变,则不影响生成氢气的总量,故B正确;
C、加氯化铁固体,过量的Fe能够与氯化铁反应,对氢离子浓度无影响,反应速率不变,故C错误;
D、NH4Cl水解呈酸性,引起H+离子的物质的量增大,影响生成氢气的总量,故D错误;
故选B.
点评 本题考查外界条件对反应速率的影响,做题时注意本题中的两个要求,从物质的性质角度考虑,本题难度不大.

练习册系列答案
相关题目
1.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用,下表列出了①~⑩10种元素在周期表中位置.
请回答:
(1)这10种元素其中化学性质最不活泼的是Ar,非金属性最强的是F,形成化合物种类最多的是C(填元素符号);
(2)第三周期列出的六种元素对应的最简离子中半径最大的是S2-,最小的是Al3+(填离子符号);
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O;
在⑤、⑦、⑧三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式);
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为HF>HCl>H2S,还原性最强是H2S(填化学式);
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是H2O或CH4(举一例即可,填化学式);
(6)用电子式表示①与⑦形成化合物的形成过程 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
(1)这10种元素其中化学性质最不活泼的是Ar,非金属性最强的是F,形成化合物种类最多的是C(填元素符号);
(2)第三周期列出的六种元素对应的最简离子中半径最大的是S2-,最小的是Al3+(填离子符号);
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O;
在⑤、⑦、⑧三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式);
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为HF>HCl>H2S,还原性最强是H2S(填化学式);
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是H2O或CH4(举一例即可,填化学式);
(6)用电子式表示①与⑦形成化合物的形成过程
 .
.
2.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为9、10、11,则HX、HY、HZ的酸性由弱到强的顺序是( )
| A. | HX、HZ、HY | B. | HY、HZ、HX | C. | HZ、HY、HX | D. | HX、HY、HZ |
19.下列各组离子在酸性溶液中能大量共存的是( )
| A. | Fe3+、NH4+、SCN-、C1- | B. | Na+、Br-、NH4+、SO42- | ||
| C. | Na+、HCO3-、K+、CO32- | D. | Fe2+、NH4+、C1-、OH- |
3.萘的结构为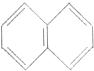 ,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
 ,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )| A. | 5种 | B. | 7种 | C. | 8种 | D. | 10种 |
 .
.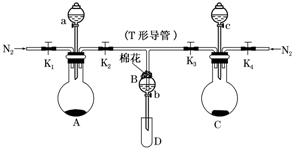 某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).
某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).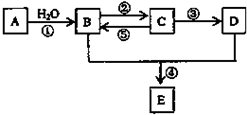 A、B、C、D、E(部分反应条件、产物被省略).其中A是一种重要的化工材料,它的产量可以用来衡量一个国家的石油化工水平;B和D式生活中两种常用的有机物;E是具有果香气味的烃的衍物.
A、B、C、D、E(部分反应条件、产物被省略).其中A是一种重要的化工材料,它的产量可以用来衡量一个国家的石油化工水平;B和D式生活中两种常用的有机物;E是具有果香气味的烃的衍物.