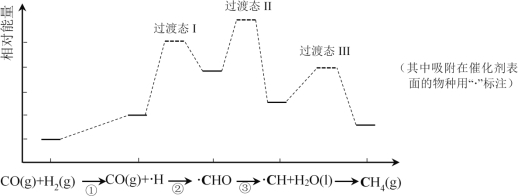
��Ŀ����
����Ŀ��I.����A������Ԫ����ɵĻ����Ϊ̽������A����ɣ���Ʋ������ʵ�飺
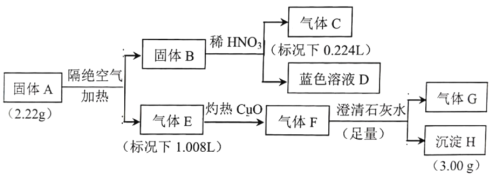
��֪������B��һ�ֵ��ʣ�����E��F����G������һ��������ɡ�
��ش�
��1�����A������Ԫ����__________������E��__________��
��2������A�����������ȷֽ�Ļ�ѧ����ʽ��__________��
��3����ɫ��ҺD���Ҵ���Ӧ�ɻ�ù���A��ͬʱ������һ�ֳ������������壬�÷�Ӧ�Ļ�ѧ����ʽΪ__________��
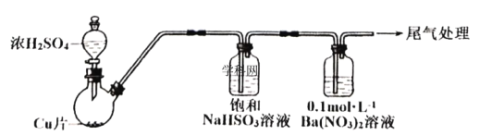
��.ij��ѧ��ȤС��Ϊ̽��SO2��![]() ��Һ�ķ�Ӧ��������װ�ã��г֡����������ԣ�����ʵ�飺�Ʊ�SO2����SO2ͨ��
��Һ�ķ�Ӧ��������װ�ã��г֡����������ԣ�����ʵ�飺�Ʊ�SO2����SO2ͨ��![]() ��Һ�У�Ѹ�ٷ�Ӧ���õ���ɫ������Һ�Ͱ�ɫ������
��Һ�У�Ѹ�ٷ�Ӧ���õ���ɫ������Һ�Ͱ�ɫ������
��1��SO2ͨ��![]() ��Һ�У��õ���ɫ������Һ�Ͱ�ɫ���������ӷ���ʽ��__________��
��Һ�У��õ���ɫ������Һ�Ͱ�ɫ���������ӷ���ʽ��__________��
��2����ͨ��![]() ��Һ�е�SO2�ѹ����������ʵ�鷽������__________��
��Һ�е�SO2�ѹ����������ʵ�鷽������__________��
���𰸡�Cu��C��N��O CO��N2 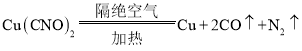
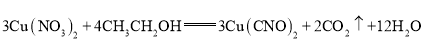
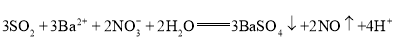 ��SO2���㣩��
��SO2���㣩��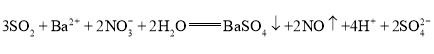 ��SO2������ ȡ������Ӧ�����Һ���Թ��У����뼸�����Ը��������Һ������ɫ��˵��ͨ���SO2�ѹ��������������𰸼��ɣ�
��SO2������ ȡ������Ӧ�����Һ���Թ��У����뼸�����Ը��������Һ������ɫ��˵��ͨ���SO2�ѹ��������������𰸼��ɣ�
��������
I������B��ϡHNO3��Ӧ��������C����ɫ��ҺD��֪������BΪCu��DΪCu(NO3)2��CΪNO����n(NO)=![]() =0.01mol����3Cu~2NO�ɵã�n(Cu)=
=0.01mol����3Cu~2NO�ɵã�n(Cu)=![]() =0.015mol��m(Cu)=0.015mol��64g/mol=0.96g��
=0.015mol��m(Cu)=0.015mol��64g/mol=0.96g��
����E������CuO��Ӧ��������F��������F����SO2��F�ͳ���ʯ��ˮ��Ӧ�г���H���ɣ���HΪCaCO3��F��CO2��E��CO����n(CaCO3)=![]() =0.03mol����Cԭ���غ�ɵã�E��n(CO)=0.03mol��m(CO)=0.03mol��28g/mol=0.84g��
=0.03mol����Cԭ���غ�ɵã�E��n(CO)=0.03mol��m(CO)=0.03mol��28g/mol=0.84g��
����A�����������ȵõ�Cu��CO��������G�����ԣ�m(G)=2.22g-0.84g-0.96g=0.42g����������E�����Ϊ1.008L�ɵã�����n(G)=![]() =0.015mol����M(G)=
=0.015mol����M(G)=![]() =28g/mol�����ԣ�GΪN2��A�У�n(N)=0.015mol��2=0.03mol����A��Cu��C��O��N�����ʵ���֮��=0.015mol:0.03mol:0.03mol:0.03mol==1:2:2:2����AΪCu(CNO)2��
=28g/mol�����ԣ�GΪN2��A�У�n(N)=0.015mol��2=0.03mol����A��Cu��C��O��N�����ʵ���֮��=0.015mol:0.03mol:0.03mol:0.03mol==1:2:2:2����AΪCu(CNO)2��
��SO2�н�ǿ��ԭ�ԣ���ͨ����Һ�п�ʹ��Һ�����ԣ�NO3-��������������ǿ�����ԣ���SO2ͨ��Ba(NO3)2�з���������ԭ��Ӧ���ݴ˽��
I��(1)�ɷ�����֪��A�к�Cu��C��N��O����Ԫ�أ�����EΪCO��N2�Ļ����ʴ�Ϊ��Cu��C��N��O��CO��N2��
(2)���ԭ���غ��д����A�����������ȵĻ�ѧ����ʽΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(3)���ԭ���غ㡢��ʧ�����غ��д��Cu(NO3)2���Ҵ���Ӧ�Ļ�ѧ����ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��(1)SO2����ԭ������������SO42-��Ba2+��SO42-��ϳ�BaSO4��NO3-��������������ԭΪNO����SO2����������������ΪBaSO4����SO2���������������BaSO4�H2SO4�����ԭ���غ㡢����غ㡢���ӵ�ʧ�غ�ɵ�SO2ͨ��BaNO3)2��Һ�з����ķ�Ӧ�����ӷ���ʽΪ��![]() (SO2����)��
(SO2����)��![]() (SO2����)���ʴ�Ϊ��
(SO2����)���ʴ�Ϊ��![]() (SO2����)��
(SO2����)��![]() (SO2����)��
(SO2����)��
(2)��ͨ��Ķ��������������Һ�н���SO2����Һ�����л�ԭ�ԣ���ʹKMnO4��Һ��ǿ��������ɫ����˿�ȡ������Ӧ�����Һ���Թ��У����뼸�����Ը��������Һ������ɫ��˵��ͨ���SO2�ѹ������ʴ�Ϊ��ȡ������Ӧ�����Һ���Թ��У����뼸�����Ը��������Һ������ɫ��˵��ͨ���SO2�ѹ��������������𰸼��ɣ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����.NOx��CO��SO2�ȴ�����Ⱦ����Ĵ�������������������о����ȵ����⡣
��1����֪��
a.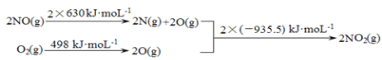
b.2NO��g����O2��g��![]() 2NO2��g�� ��H1
2NO2��g�� ��H1
2SO2��g����O2��g��![]() 2SO3��g�� ��H2=��196.6 kJ��mol-1
2SO3��g�� ��H2=��196.6 kJ��mol-1
����H1 =___kJ��mol-1��
��д��NO2������SO2���巴Ӧ����SO3�����NO������Ȼ�ѧ����ʽ____��
��2��ú̿ȼ�չ����в�����CO�ֻ���CaSO4������ѧ��Ӧ������������Ч�ʡ�������������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��Ӧ��CaSO4��s����CO��g��![]() CaO��s����SO2��g����CO2��g�� ��H1��+218.4 kJ��mol-1
CaO��s����SO2��g����CO2��g�� ��H1��+218.4 kJ��mol-1
��Ӧ��CaSO4��s����4CO��g��![]() CaS��s����4CO2��g�� ��H2��-175.6 kJ��mol-1
CaS��s����4CO2��g�� ��H2��-175.6 kJ��mol-1
�����ϣ��ٷ�Ӧ��ͷ�Ӧ��ͬʱ�������ڷ�Ӧ������ʴ��ڷ�Ӧ������ʣ�
��ش��������⣺
�����з�Ӧ���������仯ʾ��ͼ��ȷ����____��
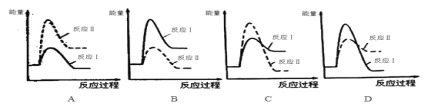
��.���淴ӦmA(g)��nB(g)![]() pC(g)��gD(g)��v��tͼ����ͼ����ʾ���������������䣬ֻ�ڷ�Ӧǰ������ʵĴ�������v��tͼ��������ʾ������˵����ȷ����___��
pC(g)��gD(g)��v��tͼ����ͼ����ʾ���������������䣬ֻ�ڷ�Ӧǰ������ʵĴ�������v��tͼ��������ʾ������˵����ȷ����___��
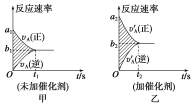
��a1��a2 ��a1��a2 ��b1��b2 ��b1��b2 ��t1��t2 ��t1��t2 ����ͼ����Ӱ���������� ��ͼ������Ӱ�����������
��.��0.5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H��0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����
2NH3(g) ��H��0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����
T/�� | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
��ش�����������
���ԱȽ�K1��K2�Ĵ�С��K1____K2(�������=������)��
��400��ʱ����Ӧ2NH3(g)![]() N2(g)+3H2(g)��ƽ�ⳣ��KΪ____�������NH3��N2��H2��Ũ�ȷֱ�Ϊ3molL1��2molL1��1molL1ʱ����÷�Ӧ��v��(N2)___v��(N2)(�������=������)��
N2(g)+3H2(g)��ƽ�ⳣ��KΪ____�������NH3��N2��H2��Ũ�ȷֱ�Ϊ3molL1��2molL1��1molL1ʱ����÷�Ӧ��v��(N2)___v��(N2)(�������=������)��