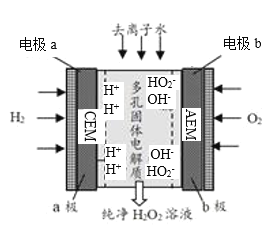
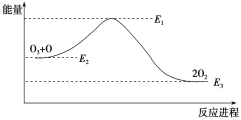
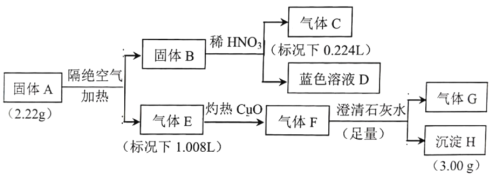
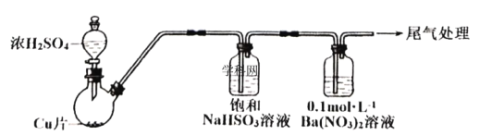
题目内容
【题目】在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)![]() 3C(g)+D(g)达到平衡时,C的浓度为1.2mol/L,C的体积分数为a%。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度不再是1.2mol/L的是
3C(g)+D(g)达到平衡时,C的浓度为1.2mol/L,C的体积分数为a%。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度不再是1.2mol/L的是
A.3mol C+1mol DB.1mol A+0.5mol B+1.5mol C+0.5mol D
C.1mol A+0.5mol B+1.5mol CD.4molA+2mol B
【答案】CD
【解析】
A. 3molC+1molD,相当于2molA、1molB,所以该反应与原反应是等效平衡,达到平衡时C的浓度为1.2mol/L,A项错误;
B. 1molA+0.5molB+1.5molC+0.5molD,相当于加入2molA和1molB,所以该反应与原反应是等效平衡,达到平衡时C的浓度为1.2mol/L,B项错误;
C. 1molA+0.5molB+1.5molC,该反应与原反应不是等效平衡,达到平衡时C的浓度不再为1.2mol/L,C项正确;
D. 4molA+2molB,等效为在原平衡的基础上压强增大一倍到达的平衡状态,与原平衡相比平衡向逆反应方向移动,达到平衡时C的浓度不再为1.2mol/L,D项正确;
答案选CD。

【题目】T℃时,向2.0L恒容密闭容器中充入0.80molA,发生反应:![]()
![]() ,经一段时间后达到平衡。反应过程中测定的部分数据见表:
,经一段时间后达到平衡。反应过程中测定的部分数据见表:
时间/min | 0 | 10 | 20 | 30 | 40 |
| 0.80 | 0.60 | 0.48 |
|
|
| 0.00 | 0.20 |
| 0.40 | 0.40 |
下列说法不正确的是
A.该反应在30min时已达到平衡
B.反应在前20min的平均速率为![]()
C.保持其他条件不变,升高温度,平衡时,![]() ,则
,则![]()
D.相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,达到平衡前的反应速率:v逆>v正
【题目】一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:
物质 | X | Y | Z |
初始物质的量/mol | 0.2 | 0.2 | 0 |
平衡物质的量/mol | 0.1 | 0.05 | 0.1 |
下列说法正确的是( )
A.反应可表示为![]() ,其平衡常数为8 000
,其平衡常数为8 000
B.增大压强使平衡向生成Z的方向移动,则平衡常数增大
C.若将容器的体积压缩至1 L,则X的体积分数减小,浓度增大
D.若升高温度,Z的浓度增大,则温度升高时![]() 正增大,
正增大,![]() 逆减小
逆减小