题目内容
16.已知反应:Ⅰ.2K2CrO4+H2SO4→K2Cr2O7+K2SO4+H2O
Ⅱ.Fe2(SO4)3+2HI→2FeSO4+I2+H2SO4
Ⅲ.K2Cr2O7+6FeSO4+7H2SO4→3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
(1)上述三个反应中,属于非氧化还原反应的是Ⅰ(填序号)
(2)Fe2(SO4)3、K2Cr2O7、I2的氧化性由强到弱的顺序为K2Cr2O7>Fe2(SO4)3>I2;
(3)反应Ⅱ中的还原产物是FeSO4;
(4)在下式中标出电子转移的方向和数目:K2Cr2O7+6FeSO4+7H2SO4→
(5)若用K2Cr2O7与HI反应,每生成12.7g I2生成,转移电子6.02×1022个个.
分析 (1)有电子转移的化学反应是氧化还原反应,其特征是有元素化合价升降;
(2)同一自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,据此判断氧化性强弱;
(3)化合价降低元素所在的产物是还原产物;
(4)氧化还原反应中,化合价升高元素失电子,化合价降低元素得到电子,化合价升降数值是相等的,据此回答;
(5)根据氧化还原反应中得失电子守恒确定反应物之间的关系,并进行相关计算即可.
解答 解:(1)三个反应中,只有Ⅰ不存在元素化合价的变化,所以属于非氧化还原反应,故答案为:Ⅰ;
(2)在③中氧化剂是K2Cr2O7,氧化产物是Fe3+,所以氧化性:K2Cr2O7>Fe3+,在②中,氧化剂是Fe3+,氧化产物是I2,所以氧化性:Fe3+>I2,综上,氧化性顺序为:K2Cr2O7>Fe2(SO4)3>I2,故答案为:K2Cr2O7>Fe2(SO4)3>I2;
(3)氧化还原反应Fe2(SO4)3+2HI→2FeSO4+I2+H2SO4中,化合价降低的Fe元素得到电子,化合价降低元素所在的产物是还原产物,所以FeSO4是还原产物,故答案为:FeSO4;
(4)该氧化还原反应中,化合价升高的铁元素失去电子,化合价降低的铬元素得到电子,得失电子数相等为6,所以反应转移电子数为6,电子转移的方向和数目如下所示: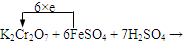 ,故答案为:
,故答案为: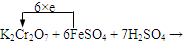 ;
;
(5)12.7g I2的物质的量是$\frac{12.7g}{254g/mol}$=0.05mol,
根据反应:K2Cr2O7+14HI═2KI+2CrI3+3I2+7H2O 转移电子
3 6mol
0.05mol 0.1mol
所以转移电子是6.02×1022个,故答案为:6.02×1022个.
点评 本题考查学生氧化还原反应的有关概念知识,注意氧化性、还原性的强弱与得失电子的难易程度有关,与得失电子的多少无关.

| A. | 透明陶瓷材料硒化锌 | B. | SO2和O2反应的催化剂五氧化二钒 | ||
| C. | 半导体材料砷化镓 | D. | 吸氢材料镧镍合金 |
 是由
是由 经两种反应而制得的,这两种反应依次是( )
经两种反应而制得的,这两种反应依次是( )| A. | 消去、加聚 | B. | 水解、缩聚 | C. | 氧化、缩聚 | D. | 取代、加聚 |
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| C. | 酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯又能除去甲烷中含有的乙烯再经干燥而获得纯净的甲烷 | |
| D. | 辛烷、己烯和苯在工业上都可直接通过石油分馏得到 |
| A. | 纤维素、油脂、蛋白质均是天然高分子化合物 | |
| B. | 聚氯乙烯塑料制品可用于食品包装 | |
| C. | “地沟油”可以食用,也可以用来制肥皂 | |
| D. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )| A. | $\frac{8M}{{N}_{A}•{a}^{3}}$g.cm-3 | B. | $\frac{M{a}^{3}}{8{N}_{A}}$gcm-3 | C. | $\frac{M}{{N}_{A}•{a}^{3}}$g.cm-3 | D. | $\frac{Ma}{{N}_{A}}$g.cm |
| A. | 向淀粉水解液中滴加碘水,检验淀粉是否已经水解 | |
| B. | 利用多次滴加Na2SO4溶液能够提纯蛋白质 | |
| C. | 加新制Cu(OH)2悬浊液加热,可检验糖尿病人尿液中的葡萄糖 | |
| D. | 除去甲苯中含有的少量苯酚,可加入NaOH溶液振荡后,静置分液 |

部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
| 离子 | Fe2+ | Fe3+ | Cu2+ |
| 开始沉淀时的pH(初始浓度为1.0mol/L) | 6.5 | 1.5 | 4.2 |
| 沉淀完全时的pH | 9.7 | 3.2 | 6.7 |
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全).
利用图中数据计算,Ksp[Zn(OH)2]=1×10-17.
(2)写出试剂a、b的化学式:a:ZnO或Zn(OH)2;b:Zn.
(3)写出加入H2O2后发生反应的离子反应方程式:H2O2+2Fe2++2H+═2Fe3++2H2O.
(4)写出沉锌过程中的离子反应方程式:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O,沉锌后溶液中主要溶质的化学式是(NH4)2SO4.
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应.写出碱式碳酸锌受热分解的化学方程式Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O.
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?能 (填“能”或“否”)