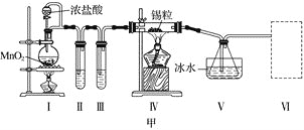
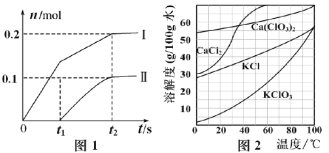
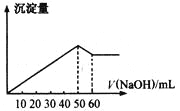
题目内容
【题目】(1)今有五种物质:①铜线 ②熔化的NaCl ③NaCl晶体 ④氨气 ⑤液态氯化氢,其中能导电的物质是__;属于电解质的是___;属于非电解质的是___。
(2)0.5molH2SO4的质量是__g,能中和___molNaOH,该硫酸所含氢元素的质量与___molNH3中所含氢元素的质量相同。
(3)相同质量的CH4和H2S中分子个数比为___。
(4)在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,n(K+)=0.2mol,n(Mg2+)=0.15mol,n(Cl-)=0.2mol,则n(NO3-)为(_____)
A.0.05mol B.0.20mol C.0.30mol D.0.40mol
【答案】①② ②③⑤ ④ 49g 1mol 0.333(1/3) 17:8 C
【解析】
(1)金属、石墨能导电,电解质在水溶液或熔化状态下能够导电;电解质在水溶液或熔化状态下能够导电的化合物;非电解质是指在水溶液里和熔化状态下都不能导电的化合物;
(2)根据m=nM计算、1mol硫酸消耗2mol氢氧化钠,结合分子中氢原子的物质的量计算;
(3)分子个数之比等于物质的量之比,结合n=![]() 计算;
计算;
(4)溶液呈电中性,溶液中c(K+)+2c(Mg2+)=c(Cl-)+c(NO3-),据此计算。
(1)①铜线是金属单质,能导电,但是既不是电解质也不是非电解质;
②熔化的NaCl能导电,属于化合物,属于电解质;
③NaCl晶体不能导电,溶于水或熔融状态下能导电,属于电解质;
④氨气不能导电,在水溶液和熔化状态下自身都不能够导电,是非电解质;
⑤液态氯化氢不能导电,溶于水能导电,属于电解;
则能导电的物质是①②;属于电解质的是②③⑤;属于非电解质的是④;
(2)0.5molH2SO4的质量是0.5mol×98g/mol=49g;硫酸与NaOH反应消耗的氢氧化钠的物质的量是硫酸的二倍,则NaOH为1mol;0.5 molH2SO4中H的物质的量为1mol,含有1molH的NH3的物质的量为![]() mol;
mol;
(3)相同质量的CH4和H2S的物质的量与摩尔质量成反比,则其分子个数比=物质的量之比=34g/mol:16g/mol=17:8;
(4)溶液呈电中性,溶液中c(K+)+2c(Mg2+)=c(Cl-)+c(NO3-),则:0.2mol/L+2×0.15mol/L=0.2mol/L+c(NO3-),解得c(NO3-)=0.3mol/L,故答案为C。

 金博士一点全通系列答案
金博士一点全通系列答案