题目内容
【题目】(1)工业上用112 L(标准状况)氯气与足量石灰乳反应,制得的漂白粉中有效成分Ca(ClO)2的最大含量为___________mol。
(2)向一定量石灰乳中缓慢通入氯气,随着反应的进行,温度升高,开始产生Ca(ClO3)2。体系中ClO-和ClO3-的物质的量(n)与反应时间(t)的关系曲线如图1所示(不考虑氯气和水的反应)。
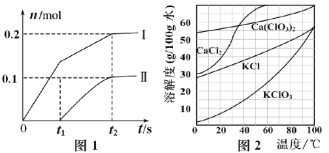
①t2时刻后,溶液中ClO-和ClO3-的物质的量之比为_____________。
②该反应过程中消耗Ca(OH)2的质量为_____________。
(3)向Ca(ClO3)2浓溶液中加入稍过量的KCl固体可转化为KClO3,如图2,从该溶液中分离出KClO3固体的实验方法是________________(不要求填具体操作步骤)。
【答案】2.5 2:1 37g 冷却结晶法或降温结晶法
【解析】
(1)根据方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O进行计算;
(2)当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图1中曲线I表示离子ClO-的物质的量随反应时间变化的关系,图中曲线Ⅱ表示ClO3-的物质的量随反应时间变化的关系;据图像及氧化还原反应中得失电子数相等进行分析和计算;
(3)从图2看出KClO3溶解度受温度影响比较大,可用冷却热饱和溶液的方法,从溶液中分离出KClO3固体。
(1)n(Cl2)= ![]() =5mol,根据方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,n(Ca(ClO)2)=
=5mol,根据方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,n(Ca(ClO)2)=![]() =2.5mol;
=2.5mol;
(2)当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图1中曲线I表示离子ClO-的物质的量随反应时间变化的关系,图中曲线Ⅱ表示ClO3-的物质的量随反应时间变化的关系;
①t2时刻后,溶液中ClO-和ClO3-的物质的量之比为0.2:0.1=2:1;
②根据氧化还原反应中得失电子数相等计算Cl-的物质的量,设被还原的氯离子的物质的量为n,则n×1=0.20mol×1+0.1mol×5=0.70mol,含氯离子的物质的量为:0.70mol+0.2mol+0.1mol=1.0mol,氯化钙、次氯酸钙、氯酸钙中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为0.5mol,质量为0.5mol×74g·mol-1=37g;
(3)向Ca(ClO3)2浓溶液中加入稍过量的KCl固体可转化为KClO3,从图2看出KClO3溶解度受温度影响比较大,可用冷却热饱和溶液的方法,从溶液中分离出KClO3固体,即:冷却结晶法或降温结晶法。