题目内容
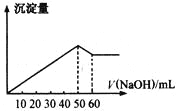
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量之比为
A.6:1B.3:1C.2:1D.1:2
【答案】D
【解析】
根据图像加入0~50mLNaOH溶液时,发生的反应为Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4、MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,50mL时,Al2(SO4)3和MgSO4恰好完全沉淀;加入50~60mLNaOH溶液时,Al(OH)3溶解,发生的反应为Al(OH)3+NaOH=NaAlO2+2H2O,加入60mLNaOH溶液时,氢氧化铝恰好完全溶解,即溶解Al(OH)3消耗了10mLNaOH溶液;所以沉淀Al2(SO4)3消耗30mLNaOH,沉淀MgSO4消耗50mL-30mL=20mLNaOH溶液,根据反应的方程式以及消耗的NaOH物质的量之比等于消耗的NaOH溶液的体积之比,原混合液中Al2(SO4)3与MgSO4的物质的量之比![]() :
:![]() =1:2,答案选D。
=1:2,答案选D。

练习册系列答案
相关题目