题目内容
11.用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl(g)+O2(g)$?_{400℃}^{催化剂}$ 2Cl2(g)+2H2O(g).(1)研究表明反应A通过如图1所示的催化剂循环实现.
反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(g)△H1
反应②生成1molCl2(g)的反应热为△H2,则A反应的反应热表示为2(△H1+△H2).(用△H1和△H2表示).
(2)反应A中,4mol HCl被氧化,放出115.6kJ的热量,且部分化学键断裂示意图如图2:
①H2O的电子式是
 ,反应A的热化学方程式是4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol.
,反应A的热化学方程式是4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol.②断开1mol H-O键与断开 1mol H-Cl 键所需能量相差约为32kJ,H2O中H-O 键比HCl中H-Cl键强(填“强”或“弱”).
(3)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl-T曲线如图3所示,若压缩体积使压强增大,画出相应ɑHCl-T曲线的示意图,并简要说明理由增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
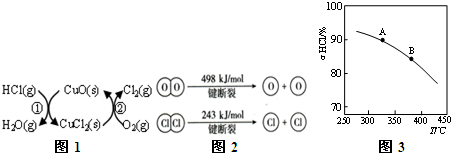
分析 (1)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+$\frac{1}{2}$O2(g)=CuO(s)+Cl2(g)△H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式;
(2)①共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况;反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出;
②反应热△H=反应物总键能-生成物的总键能,据此计算H-O键与H-Cl键的键能差,进而计算断开1mol H-O键与断开1mol H-Cl键所需能量差;
(3)正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大.
解答 解:(1)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,
反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+$\frac{1}{2}$O2(g)=CuO(s)+Cl2(g)△H2,
根据盖斯定律(①+②)×2可得总反应的热化学方程式:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2),
故答案为:2(△H1+△H2);
(2)①H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ,依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
,依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
故答案为: ;4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
;4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
②E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,
故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,所以H2O中H-O 键比HCl中H-Cl键强;
故答案为:32;强;
(3)正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大,故压缩体积使压强增大,画相应αHCl~T曲线的示意图为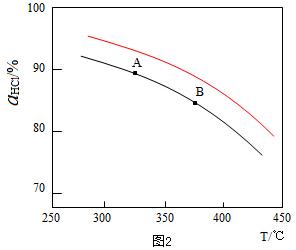 ,
,
故答案为: ,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
点评 本题比较综合,涉及热化学方程式书写、化学平衡及平衡常数影响因素等,较好的考查的分析解决问题的能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 制取乙酸乙酯时,先将1体积的酒精倒入3体积的浓硫酸中 | |
| B. | 配置银氨溶液时,将稀氨水滴加到硝酸银溶液中至沉淀恰好溶解为止 | |
| C. | 实验室做钠与乙醇的实验时,余下的钠屑投入到废液缸中 | |
| D. | 制硝基苯时,直接把盛有混合液的试管在酒精灯的外焰处加热 |
| A. | 分别配成溶液,再加入澄清石灰水 | |
| B. | 分别配成溶液,再加入CaCl2溶液 | |
| C. | 分别加热,再检验是否有使澄清石灰水变浑浊的气体产生 | |
| D. | 分别配成溶液,再进行焰色反应 |
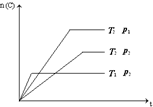
| A. | x+y=z; a>0 | B. | x+y>z; a<0 | C. | x+y<z; a<0 | D. | x+y<z; a>0 |
| A. | 根据碳酸钠溶于水呈碱性,碳酸钠既属于盐,又属于碱 | |
| B. | 根据物质是否能导电,将物质分为电解质、非电解质 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| D. | 根据化学反应过程中元素化合价是否发生变化,将化学反应分为氧化还原反应和非氧化还原反 应 |
SO42-( )
①取少量溶液于试管中,滴加 BaCl2溶液,有白色沉淀产生,往沉淀中加盐酸,无明显现象
②用干净的铂丝蘸取少量原溶液进行焰色反应,发现火焰颜色为黄色.
| A. | 有现象②可知有 Na+,没有 K+ | |
| B. | 不能确定溶液中有无 Al3+ | |
| C. | 溶液中一定存在 SO${\;}_{4}^{2-}$、Na+、K+ | |
| D. | 溶液中如果存在Cl-则肯定存在 Mg2+ |
| A. | 标准状况下,11.2 L H2O中含有的分子数为0.5 NA | |
| B. | 把40 g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol•L-1 | |
| C. | 常温常压下,16g O3中含有NA个氧原子 | |
| D. | 1 mol钠原子中含有的电子数为NA |
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA | |
| C. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| D. | 1升物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 数目为NA |
 .
.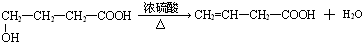 ;反应类型是:消去反应.利用C可以合成高分子化合物D,D的结构简式是:
;反应类型是:消去反应.利用C可以合成高分子化合物D,D的结构简式是: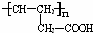 ;
; .
.