题目内容
【题目】非金属硼的合金及其化合物有着广泛的用途。
(1)硼钢合金的硬度是普通钢材的 4 倍,其主要成分是铁。 画出基态铁原子的价电子排布图_____。
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键, 则氨硼烷分子结构式为_____。写出一种与氨硼烷互为等电子体的分子_____(填化学式)。
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如右图所示。
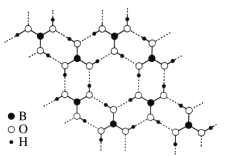
①1 mol H3BO3晶体中含有______mol 氢键。
②请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:__________。
(4)硼氢化钠是一种常用的还原剂。其晶胞结构如右图所示:

①该晶体中Na+的配位数为_____。
②H3BO3 分子中的 O—B—O 的键角_____(填“大于”、“等于”或“小于”) BH4-中的 H—B—H 的键角,判断依据是_____。
③已知硼氢化钠晶体的密度为 ρ g/cm3, NA代表阿伏伽德罗常数的值,则 a=_____(用含 ρ、 NA的代数式表示);④若硼氢化钠晶胞上下底心处的 Na+被 Li+取代,得到的晶体的化学式为_____。
【答案】 ![]()
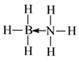 C2H6 3 硼酸分子间通过氢键结合,加热时氢键被破坏,有利于硼酸溶解 8 大于 H3BO3分子中的B采取sp2杂化,而BH4-中的B采取sp3杂化,sp2杂化形成的键角大于sp3杂化
C2H6 3 硼酸分子间通过氢键结合,加热时氢键被破坏,有利于硼酸溶解 8 大于 H3BO3分子中的B采取sp2杂化,而BH4-中的B采取sp3杂化,sp2杂化形成的键角大于sp3杂化 ![]() Na3Li(BH4)4
Na3Li(BH4)4
【解析】(1)基态铁原子的价电子排布图为![]() ;
;
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,N原子有孤对电子,B原子有空轨道,故形成配位键,所以其结构式为: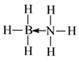 ;氨硼烷是6原子14价电子分子,与其互为等电子体的分子是:C2H6;
;氨硼烷是6原子14价电子分子,与其互为等电子体的分子是:C2H6;
(3)①根据图示,1个硼酸分子参与形成6个氢键,一个氢键由两个分子形成,所以1个硼酸分子形成3个氢键,故1 mol H3BO3晶体中含有3mol 氢键;
②由于硼酸(H3BO3)分子间形成氢键,故其溶于冷水时,与水形成的氢键数少,因此在冷水中的溶解度小,而加热时,硼酸分子间的氢键被破坏,有利于硼酸分子与水形成氢键,溶解度增大;
(4)①根据其晶胞,该晶体中 Na+周围最近的BH4-为8个,故Na+的配位数为8;
②H3BO3分子中的B采取sp2杂化,构型为平面三角形,键角为120°,而BH4-中的B采取sp3杂化,构型为正四面体,键角为109°28,故H3BO3 分子中的 O—B—O 的键角大于BH4-中的 H—B—H 的键角;
③该晶胞中有4个Na+,4个BH4-,该晶胞的体积=2a3×10-21 cm3=![]() ,故a=
,故a=![]() m;
m;
④若硼氢化钠晶胞上下底心处的 Na+被 Li+取代,则晶胞中有1个Li+,3个Na+,4个BH4-,得到的晶体的化学式为Na3Li(BH4)4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列六个说法中,正确的有
①已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为ΔH=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g) ![]() Z(g)+W(g) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(g) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
根据上表数据可以计算出C6H6(g)+3H2(g)→C6H12(g)的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25 ℃、101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A. 1个 B. 2个 C. 3个 D. 4个