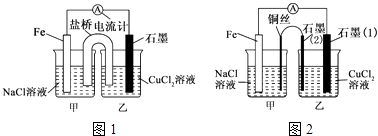
题目内容
【题目】等体积,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的示意图所示,下列说法正确的是( ) 
A.物质酸性的比较:CH3COOH>HSCN>H2CO3
B.反应结束后所得两溶液中,c(CH3COO﹣)>c(SCN﹣)
C.上述三种溶液中由水电离的c(OH﹣)大小:NaHCO3>CH3COOH>HSCN
D.CH3COOH溶液和NaHCO3溶液反应所得溶液中:c(CH3COO﹣)+c(CH3COOH)=0.10molL﹣1
【答案】C
【解析】解:A、CH3COOH溶液和HSCN溶液与NaHCO3溶液反应,生成二氧化碳气体,证明CH3COOH溶液和HSCN溶液的酸性大于碳酸,依据图象分析可知HSCN溶液比CH3COOH溶液与碳酸氢钠反应快,证明溶液中氢离子浓度大,则同浓度时说明HSCN酸性大于
CH3COOH,故A错误;
B、依据图象分析可知HSCN溶液比CH3COOH溶液与碳酸氢钠反应快,证明溶液中氢离子浓度大,则同浓度时说明HSCN酸性大于CH3COOH,反应后溶液中的CH3COO﹣水解程度大于SCN﹣,所以反应结束后所得两溶液中,c(CH3COO﹣)<c(SCN﹣),故B错误;
C、水解的盐促进水的电离,酸抑制水的电离,HSCN溶液酸性大于CH3COOH溶液,HSCN溶液中氢离子浓度大,对水的电离抑制程度大,故上述三种溶液中由水电离的c(OH﹣)大小:NaHCO3>CH3COOH>HSCN,故C正确;
D、CH3COOH溶液和NaHCO3溶液反应,生成醋酸钠和水二氧化碳,得到溶液醋酸钠,所得溶液中:c(CH3COO﹣)+c(CH3COOH)=0.050molL﹣1,故D错误;
故选C.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

【题目】某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用铬,通常采用如下流程处理:
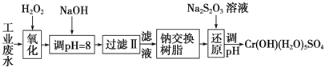
注:部分阳离子常温下沉淀时的pH见下表
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀pH | 1.4 | 7 | 9.1 | 3.4 | 4.3 |
完全沉淀pH | 3.7 | 9.6 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)氧化过程主要是氧化Fe2+和Cr3+,氧化Fe2+的目的是:________________;其中Cr3+被氧化为Cr2O72-,该反应的离子方程式为:____________,氧化Cr3+的目的是__________。
(2)选择以下合适选项填空:加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是_____。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,氧化剂和还原剂的物质的量之比为:_________________。
【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
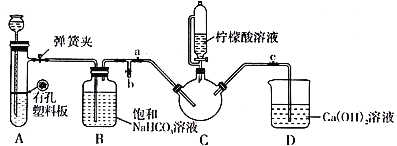
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(写化学式)。再滴加少量稀硫酸的作用是__________________________。
(2)实验II中:生成沉淀的离子方程式为__________________________。
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为___________________。
②装置A中所盛放的药品是___________________。(填序号)
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是____________________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是________________。
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为________%。