题目内容
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验: 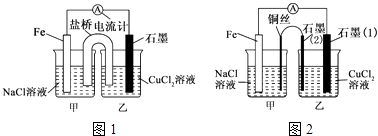
(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为 . 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过mol电子.
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式 , 这是由于NH4Cl溶液显(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因 .
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨为极(填正、负、阴、阳),乙装置中与铜线相连的石墨(2)电极上发生的反应式为 .
(4)在图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重 1.28g,则此时溶液的pH为 .
【答案】
(1)Fe+Cu2+=Cu+Fe2+;0.2
(2)2H++2e﹣=H2↑;酸性; NH4++H2O?NH3?H2O+H+
(3)阴;2Cl﹣﹣2e﹣=Cl2↑
(4)1
【解析】解:(1)设计的原电池装置的自发氧化还原反应是:Fe+Cu2+=Cu+Fe2+,设电子转移量是x,则64×0.5x+56×0.5x=12,解得x=0.2,
所以答案是:Fe+Cu2+=Cu+Fe2+;0.2;(2)氯化铵中,铵根离子水解导致溶液显示酸性,实质是:NH4++H2ONH3H2O+H+,正极发生2H++2e﹣=H2↑,
所以答案是:2H++2e﹣=H2↑;酸性;NH4++H2ONH3H2O+H+;(3)其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池,Fe是负极,Cu丝是正极,所以其中与铜线相连石墨电极是阳极,该极上发生的反应式为2Cl﹣﹣2e﹣=Cl2↑,所以答案是:阴;2Cl﹣﹣2e﹣=Cl2↑;(4)阴极反应:Cu2++2e﹣=Cu,当该极增重1.28g即0.02mol时,转移电子是0.04mol,总反应式为2CuSO4+2H2O ![]() 2Cu+2H2SO4+O2↑,可知生成0.04molH+,
2Cu+2H2SO4+O2↑,可知生成0.04molH+,
则c(H+)= ![]() =0.1mol/L,pH=1,
=0.1mol/L,pH=1,
所以答案是:1.

【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO32- |
B |
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-lNaCl、NaI的混合溶液中滴加2滴0.01mol·L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-l NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D



