题目内容
【题目】某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用铬,通常采用如下流程处理:

注:部分阳离子常温下沉淀时的pH见下表
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀pH | 1.4 | 7 | 9.1 | 3.4 | 4.3 |
完全沉淀pH | 3.7 | 9.6 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)氧化过程主要是氧化Fe2+和Cr3+,氧化Fe2+的目的是:________________;其中Cr3+被氧化为Cr2O72-,该反应的离子方程式为:____________,氧化Cr3+的目的是__________。
(2)选择以下合适选项填空:加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是_____。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,氧化剂和还原剂的物质的量之比为:_________________。
【答案】 氧化为Fe3+之后,可以通过调节溶液pH除去 2Cr3++3H2O2+H2O=Cr2O72-+8H+ 防止调节溶液pH时将Cr元素沉淀除去 AB CD 4∶3
【解析】某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为Cr3+,再调节pH得到Cr(OH)(H2O)5SO4,据此解答。
(1)根据以上分析可知氧化Fe2+的目的是将亚铁离子氧化为Fe3+之后,可以通过调节溶液pH除去:其中Cr3+被氧化为Cr2O72-,根据电子得失守恒可知该反应的离子方程式为2Cr3++3H2O2+H2O=Cr2O72-+8H+;根据表中数据可知氧化Cr3+的目的是防止调节溶液pH时将Cr元素沉淀除去。
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去,答案选AB;通过钠离子交换树脂,除去Ca2+和Mg2+,答案选CD;
(3)还原过程中Cr元素化合价从+6价降低到+3价,1molCr2O72-得到6mol电子。S元素化合价从+2价升高到+6价,则1molNa2S2O3失去8mol电子,所以根据电子得失守恒可知氧化剂和还原剂的物质的量之比为8∶6=4∶3。

 阶梯计算系列答案
阶梯计算系列答案【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO32- |
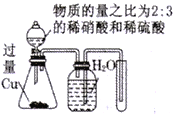
B |
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-lNaCl、NaI的混合溶液中滴加2滴0.01mol·L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-l NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D