题目内容
【题目】磷的单质及其化合物用途非常广泛。回答下列问题:
(1)基态磷原子价电子轨道表示式为______________________;磷的第一电离能比硫大,其原因是_____________________________________________。
(2)已知反应6P2H4==P4+ 8PH3↑。P2H4分子中磷原子杂化类型是________________;P4分子的几何构型是________________________。
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是_________________________;NH3分子中键角比PH3分子中键角大,其原因是______________________________________________。
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________________________________________。
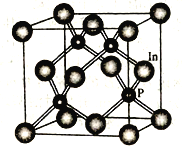
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In 的配位数为_______________;与In原子间距离为![]() a nm 的In 原子有________个。
a nm 的In 原子有________个。
【答案】 ![]() 磷的3P轨道处于半充满状态,较稳定 sp3 正四面体 NH3分子间可以形成氢键,PH3不能 N的电负性大于P,成键电子对偏向N,从而增加了成键电子对间的斥力,键角变大 磷的原子半径大,磷原子间形成的σ键较长,p一p轨道间肩并肩重叠程度很小或几乎不能重叠,难以形成π键 4 12
磷的3P轨道处于半充满状态,较稳定 sp3 正四面体 NH3分子间可以形成氢键,PH3不能 N的电负性大于P,成键电子对偏向N,从而增加了成键电子对间的斥力,键角变大 磷的原子半径大,磷原子间形成的σ键较长,p一p轨道间肩并肩重叠程度很小或几乎不能重叠,难以形成π键 4 12
【解析】(1)P为15号元素,P的核外电子排布式为1s22s22p63s23p3,则其价电子排布式为3s23p3,所以基态磷原子价电子轨道表示式为![]() ,磷原子最外层能级中,3p电子处于半满状态,相对比较稳定,失电子较难。答案为:
,磷原子最外层能级中,3p电子处于半满状态,相对比较稳定,失电子较难。答案为: ![]() 、磷的3P轨道处于半充满状态,较稳定
、磷的3P轨道处于半充满状态,较稳定
(2)P2H4分子中磷原子可以形成3个σ键,还有1对孤对电子,所以磷原子杂化类型是sp3杂化;在白磷中,磷原子的5个价电子中的3个形成了3个σ键,还剩下1个未成键价电子对,其非π键价层电子对总数是4,需要形成4个杂化轨道而采用sp3杂化,所以白磷分子是正四面体形结构。答案为:sp3 、正四面体
(3)①NH3和PH3为分子晶体,随着相对分子质量的增大,分子间作用力逐渐增大,熔沸点逐渐升高,但是NH3分子间可以形成氢键,PH3不能,故NH3的沸点比PH3高;N的电负性大于P,NH3中N-H键的键长比PH3中P-H键的键长要短,所以在NH3中成键电子对更靠近N,排斥力更大,以致键角更大. ②P原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,所以难以形成π键。故答案为:①NH3分子间可以形成氢键,PH3不能 、N的电负性大于P,成键电子对偏向N,从而增加了成键电子对间的斥力,键角变大 ②磷的原子半径大,磷原子间形成的σ键较长,p一p轨道间肩并肩重叠程度很小或几乎不能重叠,难以形成π键
(4)根据晶胞图可知磷化铟晶胞中:In原子数目为8×![]() +6×
+6×![]() =4,P原子数目为4,所以In的配位数为4;由于晶胞的边长为anm,设晶胞中在一个平面上处于对角线上的In原子间距离为x nm,则x2=a2+ a2,所以x=
=4,P原子数目为4,所以In的配位数为4;由于晶胞的边长为anm,设晶胞中在一个平面上处于对角线上的In原子间距离为x nm,则x2=a2+ a2,所以x=![]() anm,因此与In原子间距离为
anm,因此与In原子间距离为![]() anm的In原子有几个,也就是In原子周围与In原子处于对角线中心的In原子有几个,根据晶胞结构图可知有12个。答案为:4、 12
anm的In原子有几个,也就是In原子周围与In原子处于对角线中心的In原子有几个,根据晶胞结构图可知有12个。答案为:4、 12

 阅读快车系列答案
阅读快车系列答案


