题目内容
【物质结构与性质】
碳、氮、氧是构成生命物质的三种主要元素。
(1)碳、氮、中,原子核外电子未成对电子数最多的是 (用元素符号表示)。
(2)已知CN-与N2结构相似,则HCN分子中σ键与π键数目之比为 。
(3)H2O2分子中氧原子的杂化方式为 。
(4)与NO2+互为等电子体的微粒有 、 (举2例),NO3-的空间构型是 。
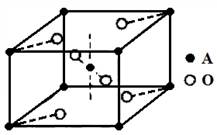
(5)已知元素A的氧化物的晶胞结构如图所示,则该氧化物的化学式为 。
碳、氮、氧是构成生命物质的三种主要元素。
(1)碳、氮、中,原子核外电子未成对电子数最多的是 (用元素符号表示)。
(2)已知CN-与N2结构相似,则HCN分子中σ键与π键数目之比为 。
(3)H2O2分子中氧原子的杂化方式为 。
(4)与NO2+互为等电子体的微粒有 、 (举2例),NO3-的空间构型是 。
(5)已知元素A的氧化物的晶胞结构如图所示,则该氧化物的化学式为 。

(1)N
(2)1:1
(3)sp3
(4)CO2、N2O、CNO-、SCN-等;平面三角形
(5)AO2
(2)1:1
(3)sp3
(4)CO2、N2O、CNO-、SCN-等;平面三角形
(5)AO2
(1)根据核外电子排布规律可知,碳、氮、氧三种元素的核外电子排布分别为1s22s22p2、1s22s22p3、1s22s22p4,因此原子核外电子未成对电子数最多的是N元素。
(2)已知CN-与N2结构相似,因些HCN分子结构式为H-C≡N,σ键与π键之比是1:1。
(3)H2O2分子中氧原子分别形成2个单键,另外还原2对孤对电子,所以氧原子的价层电子对数是4,因此氧原子的杂化类型是sp3。
(4)原子数和价电子数分别都相等的互为等电子体,则与NO2-互为等电子的微粒有CO2、N2O、CNO-、SCN-等;NO3-含有的孤电子对数是(5+1-3×2)=0,所以它的空间构型是平面三角形。
(5)根据晶胞结构知,A原子数是=1+8×1/8=2,O原子数=2+4×1/2=4,则该氧化物的化学式为AO2。
(2)已知CN-与N2结构相似,因些HCN分子结构式为H-C≡N,σ键与π键之比是1:1。
(3)H2O2分子中氧原子分别形成2个单键,另外还原2对孤对电子,所以氧原子的价层电子对数是4,因此氧原子的杂化类型是sp3。
(4)原子数和价电子数分别都相等的互为等电子体,则与NO2-互为等电子的微粒有CO2、N2O、CNO-、SCN-等;NO3-含有的孤电子对数是(5+1-3×2)=0,所以它的空间构型是平面三角形。
(5)根据晶胞结构知,A原子数是=1+8×1/8=2,O原子数=2+4×1/2=4,则该氧化物的化学式为AO2。

练习册系列答案
相关题目
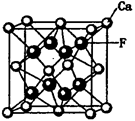
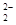 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C
存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C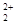 互为等电子体,O
互为等电子体,O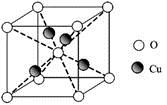

 CO + H2S
CO + H2S