题目内容
(16分)已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1—18纵列中的第10、12纵列元素。请回答下列问题:
(1)D元素在周期表位置是 ,G的核外价层电子排布式为 。
(2)E与A形成的化合物比F与A形成的化合物的沸点 (填“高”或“低”),其原因是 。
(3)B、C原子的第一电离能较大的是 (填元素符号),其原因是 。
(4)BD32-离子中B原子采取 杂化,任写一种与BD互为等电子体的分子的电子式 。
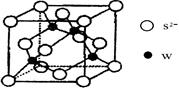
(5)元素H的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式是 。元素H的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式为 。
(1)D元素在周期表位置是 ,G的核外价层电子排布式为 。
(2)E与A形成的化合物比F与A形成的化合物的沸点 (填“高”或“低”),其原因是 。
(3)B、C原子的第一电离能较大的是 (填元素符号),其原因是 。
(4)BD32-离子中B原子采取 杂化,任写一种与BD互为等电子体的分子的电子式 。
(5)元素H的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式是 。元素H的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式为 。

(1)第二周期,第VIA族(2分),3d84s2(2分)。
(2)高(1分),HF分子间存在氢键(1分)。
(3)N(1分),N原子的p轨道是半充满状态(1分)。
(4)sp2(2分), N N(2分)。(5)ZnS(2分)。 Zn(OH)2+4NH3="[" Zn (NH3)4]2++2OH-(2分)。
(2)高(1分),HF分子间存在氢键(1分)。
(3)N(1分),N原子的p轨道是半充满状态(1分)。
|
|
|
|
试题分析:根据题意知,A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,则A为氢元素;B原子最外层电子数是内层电子数的两倍,则B为碳元素;C的基态原子核外有7种不同运动状态的电子,则C为氮元素;E是电负性最大的元素,则E为氟元素;又它们的原子序数依次增大,则D为氧元素;F的氢化物和最高价氧化物对应的水化物均为强酸,则F为氯元素;G、H分别是周期表中1—18纵列中的第10、12纵列元素,则G为镍元素,H为锌元素。(1)D为氧元素,在周期表位置是第二周期,第VIA族;,G为28号元素镍元素,核外价层电子排布式为3d84s2;(2)HF比HCl的沸点高,其原因是HF分子间存在氢键;(3)C、N原子的第一电离能较大的是N,其原因是N原子的p轨道是半充满状态,较稳定;(4)根据价层电子对互斥理论判断,CO32-离子中C原子采取sp2杂化,根据等电子体的概念判断,与CO互为等电子体的分子为N2,电子式见答案。(5)根据锌的硫化物晶体的晶胞结构,利用切割法判断,该硫化物的化学式是ZnS。元素锌的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,该反应的离子方程式为Zn(OH)2+4NH3="[" Zn (NH3)4]2++2OH-。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。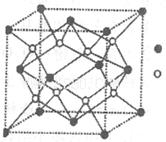
 键:
键:
 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。 的价层电子排布图为_____
的价层电子排布图为_____