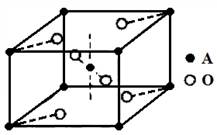
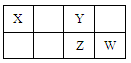
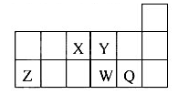
题目内容
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:

试回答以下问题
(1)B在周期表中的位置是 。B的氢化物与E的氢化物比较,沸点较高的是 (填化学式),在水中溶解度较大的是 (填化学式)
(2)写出D3B与甲反应所得溶液呈 (填“酸性”、“碱性”或“中性”),原因是(用化学方程式表示) 。
(3)写出丙的电子式为 。说明丙的水溶液在放置过程中其酸性会增强的原因(用离子方程式表示) 。
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。可用来鉴别丁和氯化钠的试剂有
A.氢碘酸和淀粉的混合液 B.AgNO3溶液
C.甲基橙试剂 D.稀硫酸
(5)将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式 。
(1)第二周期ⅤA族,NH3,NH3
(2)碱性,Na3N+3H2O= NH3↑+3NaOH
(3) ,2HClO
,2HClO  2H++2Cl-+ O2↑
2H++2Cl-+ O2↑
(4)AD(2分)
(5)Cu +2NO2- +4H+ = Cu2+ +2NO↑+2H2O
(2)碱性,Na3N+3H2O= NH3↑+3NaOH
(3)
 ,2HClO
,2HClO 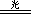 2H++2Cl-+ O2↑
2H++2Cl-+ O2↑(4)AD(2分)
(5)Cu +2NO2- +4H+ = Cu2+ +2NO↑+2H2O
由题意知,钠在空气中燃烧生成淡黄色固体过氧化钠,D为Na;D3B中阴阳离子电子层结构相同可推出D、B分别为Na、N;则A为H、C为O;丙的相对分子质量为87,若丙中含有1个O,则丙为Cl2O;若丙中含有2个O,不合题意;若丙中含有3个O,丙为KO3,但KO3不是气态,所以E为Cl。
(1)N位于第二周期VA族。NH3存在分子间氢键,HCl分子间不存在氢键,NH3的沸点高于HCl;NH3和HCl都是极性分子,都能溶于水,但NH3与水能形成分子间氢键,NH3在水中溶解度大于HCl。
(2)Na3N与H2O生成NaOH与NH3,溶液呈碱性。
(3)Cl2O结构式为Cl-O-Cl,电子式为 。Cl2O与水生成HClO,HClO光照条件下生成盐酸和氧气,溶液酸性增强。
。Cl2O与水生成HClO,HClO光照条件下生成盐酸和氧气,溶液酸性增强。
(4)丁为NaNO2。NaNO2能与氢碘酸生成I2,淀粉遇碘变蓝,A正确;亚硝酸钠与氯化钠与硝酸银溶液均生成白色沉淀,B错误;甲基橙变色范围是3.1~4.4,氯化钠溶液与亚硝酸钠溶液遇甲基橙溶液均呈黄色,C错误;亚硝酸钠与稀硫酸生成亚硝酸,亚硝酸分解生成红棕色气体二氧化氮,D正确。
(5)酸性条件下,NO2-具有氧化性,能将Cu氧化生成Cu2+,NO2-本身被还原为NO。
(1)N位于第二周期VA族。NH3存在分子间氢键,HCl分子间不存在氢键,NH3的沸点高于HCl;NH3和HCl都是极性分子,都能溶于水,但NH3与水能形成分子间氢键,NH3在水中溶解度大于HCl。
(2)Na3N与H2O生成NaOH与NH3,溶液呈碱性。
(3)Cl2O结构式为Cl-O-Cl,电子式为
 。Cl2O与水生成HClO,HClO光照条件下生成盐酸和氧气,溶液酸性增强。
。Cl2O与水生成HClO,HClO光照条件下生成盐酸和氧气,溶液酸性增强。(4)丁为NaNO2。NaNO2能与氢碘酸生成I2,淀粉遇碘变蓝,A正确;亚硝酸钠与氯化钠与硝酸银溶液均生成白色沉淀,B错误;甲基橙变色范围是3.1~4.4,氯化钠溶液与亚硝酸钠溶液遇甲基橙溶液均呈黄色,C错误;亚硝酸钠与稀硫酸生成亚硝酸,亚硝酸分解生成红棕色气体二氧化氮,D正确。
(5)酸性条件下,NO2-具有氧化性,能将Cu氧化生成Cu2+,NO2-本身被还原为NO。

练习册系列答案
相关题目