题目内容
碳、氮、氧、氟都是位于第二周期的重要的非金属元素。请回答下列问题:
(1)基态氟原子的核外电子排布式是______________ 。
(2)C、N、O、F四种元素第一电离能从大到小的顺序是_________________。
(3)碳和另外三种元素均可形成化合物。四氟化碳的空间构型为____________,CF4可以利用甲烷与Cl2和HF在一定条件下反应来制备,其反应方程式为___________;CO是__________分子(填“极性”或“非极性”),CO的常见等电子体为N2、CN-,已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________;C3N4是一种新型材料,它的硬度比金刚石还高,可做切割工具,可推测出C3N4属于_________晶体。
(4)N4分子结构和白磷一样都是正四面体。又已知断裂1molN-N键吸收167kJ热量,生成1 molN≡N键放出942kJ热量,0.1 molN4转变为N2将放出____________热量:
(5)CaF2和CaC2都属于离子晶体。CaF2晶体的密度为a g·cm-3,则晶胞(如图)的体积是_______________(只要求列出算式)。

(6)CaC2晶体的晶胞与氯化钠相似,但由于CaC2晶体中的C 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C
存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C 周围距离最近且相等的Ca2+数目为__________,C
周围距离最近且相等的Ca2+数目为__________,C 与O
与O 互为等电子体,O
互为等电子体,O 的电子式为____________。
的电子式为____________。
(1)基态氟原子的核外电子排布式是______________ 。
(2)C、N、O、F四种元素第一电离能从大到小的顺序是_________________。
(3)碳和另外三种元素均可形成化合物。四氟化碳的空间构型为____________,CF4可以利用甲烷与Cl2和HF在一定条件下反应来制备,其反应方程式为___________;CO是__________分子(填“极性”或“非极性”),CO的常见等电子体为N2、CN-,已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________;C3N4是一种新型材料,它的硬度比金刚石还高,可做切割工具,可推测出C3N4属于_________晶体。
(4)N4分子结构和白磷一样都是正四面体。又已知断裂1molN-N键吸收167kJ热量,生成1 molN≡N键放出942kJ热量,0.1 molN4转变为N2将放出____________热量:
(5)CaF2和CaC2都属于离子晶体。CaF2晶体的密度为a g·cm-3,则晶胞(如图)的体积是_______________(只要求列出算式)。

(6)CaC2晶体的晶胞与氯化钠相似,但由于CaC2晶体中的C
 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C
存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C 周围距离最近且相等的Ca2+数目为__________,C
周围距离最近且相等的Ca2+数目为__________,C 与O
与O 互为等电子体,O
互为等电子体,O 的电子式为____________。
的电子式为____________。(1)1s22s22p5 (1分) (2)F>N>O>C (2分)
(3)正四面体(1分) CH4 + 4 Cl2 + 4 HF CF4 + 8 HCl(2分)。
CF4 + 8 HCl(2分)。
极性(1分) 1:1(或2:2)(1分)原子(1分)
(4) 88.2 kJ(2分) (5)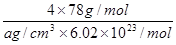 (2分)
(2分)
(6) 4 (1分)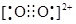 (1分)
(1分)
(3)正四面体(1分) CH4 + 4 Cl2 + 4 HF
 CF4 + 8 HCl(2分)。
CF4 + 8 HCl(2分)。极性(1分) 1:1(或2:2)(1分)原子(1分)
(4) 88.2 kJ(2分) (5)
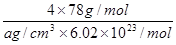 (2分)
(2分)(6) 4 (1分)
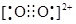 (1分)
(1分) 试题分析:(1)氟是9号元素,基态原子的核外电子排布式是1s22s22p5;
(2) 第一电离能N因2p轨道电子半充满稳定而比O大,故 F>N>O>C;
(3) 四氟化碳的空间构型为正四面体,制备反应是 CH4 + 4 Cl2 + 4 HF
 CF4 + 8 HCl;CO不对称,是极性分子;由N2确定HCN分子的结构式是H—C≡N,分子中σ键与π键数目之比为2:2=1:1;C3N4的硬度比金刚石还高,说明是原子晶体。
CF4 + 8 HCl;CO不对称,是极性分子;由N2确定HCN分子的结构式是H—C≡N,分子中σ键与π键数目之比为2:2=1:1;C3N4的硬度比金刚石还高,说明是原子晶体。(4) N4分子结构和白磷一样都是正四面体,说明有6个N-N。由N4="2" N2可知,0.1 molN4转变为N2将放出热量为0.1×(6×167-2×942)=" 88.2" (kJ)。
(5)晶胞中的Ca2+是4个,F-是8个,由密度为a g·cm-3=
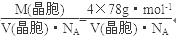
得CaF2晶胞的体积:
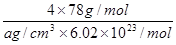 。
。(6)CaC2晶体的晶胞与氯化钠相似,Cl-的周围距离最近有6个Na+,由于CaC2晶体中的C
 存在,使晶胞沿一个方向拉长,使2Ca2+拉远了,实验CaC2晶体中1个C
存在,使晶胞沿一个方向拉长,使2Ca2+拉远了,实验CaC2晶体中1个C 周围距离最近且相等的Ca2+数目为4,C
周围距离最近且相等的Ca2+数目为4,C 与N2等电子体,故O
与N2等电子体,故O 与N2等电子体,电子式是
与N2等电子体,电子式是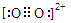 。
。
练习册系列答案
相关题目



