题目内容
【题目】向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的质量与所加碱的体积如图所示:
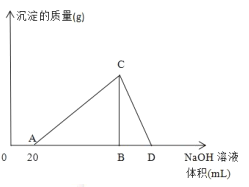
(1)写出AC段和CD段发生反应的离子方程式:
AC_______________________________________
CD_______________________________________
(2)盐酸溶液的浓度是____________________。
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是__________________。
(4)D点表示的氢氧化钠溶液的体积是______________________。
【答案】Al3++3OH-→Al(OH)3↓ Al(OH)3+OH-→AlO2-+2H2O 1mol·L-1 50mL或90mL 100mL
【解析】
向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,先中和溶液中的盐酸,继续滴加NaOH溶液开始生成Al(OH)3沉淀,当沉淀量最多的时候,再滴加NaOH溶液开始溶解Al(OH)3沉淀,直至沉淀完全溶解为止。
(1)向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,OA段是中和盐酸,AC段是生成Al(OH)3沉淀,发生反应的离子方程式为Al3++3OH-→Al(OH)3↓;CD段是NaOH溶液开始溶解Al(OH)3沉淀,发生反应的离子方程式为Al(OH)3+OH-→AlO2-+2H2O;
(2)设盐酸的浓度为cmol/L,OA段是中和盐酸消耗20mLNaOH溶液,则cmol/L×0.02L=0.02L×1mol/L,解得:c=1,即盐酸溶液的浓度是1mol/L;
(3)0.78g Al(OH)3白色沉淀的物质的量为![]() =0.01mol,AC段是生成Al(OH)3沉淀,发生反应的离子方程式为Al3++3OH-→Al(OH)3↓,则生成0.01molAl(OH)3沉淀需要的NaOH的物质的量为0.03mol,消耗NaOH溶液的体积为
=0.01mol,AC段是生成Al(OH)3沉淀,发生反应的离子方程式为Al3++3OH-→Al(OH)3↓,则生成0.01molAl(OH)3沉淀需要的NaOH的物质的量为0.03mol,消耗NaOH溶液的体积为![]() 0.03L=30ml;
0.03L=30ml;
溶液中共有AlCl3的物质的量为0.02mol,则最多生成0.02molAl(OH)3沉淀,沉淀时消耗NaOH溶液的体积为![]() =0.06L=60mL;CD段是NaOH溶液开始溶解Al(OH)3沉淀,发生反应的离子方程式为Al(OH)3+OH-→AlO2-+2H2O,则溶解0.01molAl(OH)3沉淀需要NaOH的物质的量为0.01mol,消耗的NaOH溶液体积为
=0.06L=60mL;CD段是NaOH溶液开始溶解Al(OH)3沉淀,发生反应的离子方程式为Al(OH)3+OH-→AlO2-+2H2O,则溶解0.01molAl(OH)3沉淀需要NaOH的物质的量为0.01mol,消耗的NaOH溶液体积为![]() 0.01L=10ml;
0.01L=10ml;
故产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是50mL或90mL;
(4)CD段NaOH溶液溶解0.02molAl(OH)3沉淀,需要的NaOH的物质的量为0.02mol,NaOH溶液体积为![]() =0.02L=20mL,则D点表示的氢氧化钠溶液的体积是100mL。
=0.02L=20mL,则D点表示的氢氧化钠溶液的体积是100mL。

 名校课堂系列答案
名校课堂系列答案