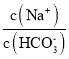题目内容
【题目】通过对阳极泥的综合处理可以回收宝贵的金属,一种从铜阳极泥(主要成分为Se、Ag2Se、Ag、Cu、CuSO4和Cu2S等)中分离Ag、Se和Cu的新工艺流程如图所示:
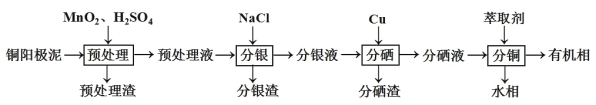
(1)已知预处理温度为80℃,预处理渣中几乎不含有单质S,则预处理时Cu2S发生反应的离子方程式为___。从环保角度来看,本工艺中采用稀H2SO4添加适量MnO2做预处理剂与传统工艺中采用浓硫酸作氧化剂相比的主要优点是___。
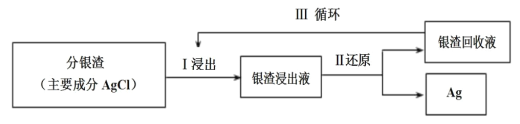
(2)回收分银渣中的银,可用如图过程:
已知:S2O![]() -易与银离子发生络合反应:Ag++2S2O
-易与银离子发生络合反应:Ag++2S2O![]()
![]() Ag(S2O3)
Ag(S2O3)![]() 。在常温下,上述络合反应的平衡常数为:K稳[Ag(S2O3)
。在常温下,上述络合反应的平衡常数为:K稳[Ag(S2O3)![]() ]=
]=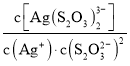 =2.8×1013,Ksp(AgCl)=1.8×10-10
=2.8×1013,Ksp(AgCl)=1.8×10-10
①Ⅰ中发生的离子反应方程式为:AgCl(s)+2S2O![]()
![]() Ag(S2O3)
Ag(S2O3) ![]() (aq)+Cl-(aq),则常温下此反应的平衡常数K为___(结果保留二位小数)。
(aq)+Cl-(aq),则常温下此反应的平衡常数K为___(结果保留二位小数)。
②Ⅲ中银渣回收液可直接循环使用,但循环多次后,银的浸出率会降低。从化学平衡的角度分析原因:___。
(3)分硒渣的主要成分是Cu2Se,可被氧化得到亚硒酸(H2SeO3)。已知常温下H2SeO3的Ka1=2.7×10-3,Ka2=2.5×10-8,则NaHSeO3溶液的pH___7(填“>”、“<”或“=”)。硒酸(H2SeO4)可以用氯水氧化亚硒酸得到,该反应化学方程式为___。
(4)分铜得到产品CuSO4·5H2O的具体操作如图:

其中萃取与反萃取原理为:2RH+Cu2+![]() R2Cu+2H+,反萃取剂最好选用___(填化学式)溶液。
R2Cu+2H+,反萃取剂最好选用___(填化学式)溶液。
【答案】Cu2S+5MnO2+12H+=2Cu2++SO42-+5Mn2++6H2O 减少污染性气体SO2的排放 5.04×103 随循环次数增加,浸出液中c(Cl-)增大,AgCl(s)+2S2O32-(aq)![]() Ag(S2O3)23-(aq)+Cl-(aq)平衡左移,故浸出率下降 < H2SeO3+Cl2+H2O=H2SeO4+2HCl H2SO4
Ag(S2O3)23-(aq)+Cl-(aq)平衡左移,故浸出率下降 < H2SeO3+Cl2+H2O=H2SeO4+2HCl H2SO4
【解析】
铜阳极泥(主要成分为Se、Ag2Se、Ag、Cu、CuSO4和Cu2S等) ,加入二氧化锰、硫酸进行预处理,可将Cu2S氧化生成硫酸铜,减少污染物的排放,滤液加入NaCl,可生成AgCl,滤液加入Cu,得到Cu2Se,分硒液含有铜,萃取得到R2Cu,经反萃取可得铜的水溶液,可用于制备硫酸铜晶体等。
(1)预处理温度为80°C,预处理渣中几乎不含S元素,应生成硫酸盐,预处理时Cu2S发生反应的离子方程式为:Cu2S+5MnO2+12H+=2Cu2++SO42-+5Mn2++6H2O;采用稀H2SO4溶液添加MnO2做预处理剂,稀硫酸提供了酸性环境,MnO2作氧化剂,可以氧化Cu2S,若用浓硫酸作氧化剂,浓硫酸中+6价的S会被还原为+4价,产生二氧化硫,污染空气;
(2)①Ⅰ中发生的离子反应方程式为:AgCl(s)+2S2O![]()
![]() Ag(S2O3)
Ag(S2O3) ![]() (aq)+Cl-(aq),该反应的平衡常数
(aq)+Cl-(aq),该反应的平衡常数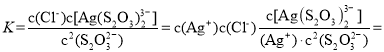
![]() ;
;
②Ⅲ中银渣回收液可直接放入Ⅰ过程循环使用,方程式为:AgCl(s)+2S2O![]()
![]() Ag(S2O3)
Ag(S2O3) ![]() (aq)+Cl-(aq),多次循环后,浸出液中S2O
(aq)+Cl-(aq),多次循环后,浸出液中S2O![]() 的浓度减小,Cl-的浓度增大,平衡向逆向移动,浸出率下降;
的浓度减小,Cl-的浓度增大,平衡向逆向移动,浸出率下降;
(3)常温下![]() 的水解平衡常数为
的水解平衡常数为![]() ,
,![]() 的电离平衡常数为2.5×10-8,故Kh<Ka2,即
的电离平衡常数为2.5×10-8,故Kh<Ka2,即![]() 的水解小于电离,所以NaHSeO3溶液显酸性,pH<7;亚硒酸被氯水中的氯气氧化为硒酸,氯气的0价氯降为-1价,方程式为:H2SeO3+Cl2+H2O=H2SeO4+2HCl;
的水解小于电离,所以NaHSeO3溶液显酸性,pH<7;亚硒酸被氯水中的氯气氧化为硒酸,氯气的0价氯降为-1价,方程式为:H2SeO3+Cl2+H2O=H2SeO4+2HCl;
(4)反萃取后生成CuSO4,根据萃取原理2RH+Cu2+![]() R2Cu+2H+,则应增大氢离子浓度,使平衡逆向移动,同时不引入新杂质,所以选择H2SO4作反萃取剂;
R2Cu+2H+,则应增大氢离子浓度,使平衡逆向移动,同时不引入新杂质,所以选择H2SO4作反萃取剂;