题目内容
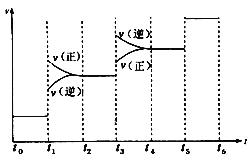
【题目】某化学课外活动小组应用下图所示的方法研究物质的性质,其中气体E的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:

(1)该项研究(实验)的主要目的是________。
(2)浓H2SO4的作用是_________。
(3)从物质性质的方面来看,这样的实验设计存在事故隐患,事故隐患是________。请在图中的D处以图像的形式表明消除事故隐患的措施_______,其中发生反应的化学方程式为__________。
【答案】探究使有色布条退色的物质 吸收气体E中的水蒸气 多余的Cl2污染空气、危害实验人员身体 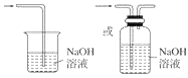 Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1)探究氯气能否与水发生反应,应先除去氯气中的水蒸气,浓硫酸起到干燥氯气的作用;
(2)装置B中的有色布条不褪色,说明干燥的氯气不能使有色布条褪色,装置C中的有色布条褪色,说明氯气与水反应后的生成物使有色布条褪色;
(3)氯气有毒,为防止空气污染,应该有尾气吸收装置,可用碱溶液吸收氯气。
(1)探究氯气能否与水发生反应,应先除去氯气中的水蒸气,浓硫酸起到干燥氯气的作用,
故答案为:探究使有色布条褪色的物质;
(2)装置B中的有色布条不褪色,说明干燥的氯气不能使有色布条褪色,装置C中的有色布条褪色,说明氯气与水反应后的生成物使有色布条褪色。
故答案为:吸收气体E中的水蒸气;
(3)氯气有毒,为防止空气污染,应该有尾气吸收装置,可用碱溶液吸收氯气,发生的反应为:Cl2+2NaOH=NaCl+NaClO+H2O,尾气吸收装置图为: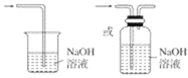 ,
,
故答案为:多余的Cl2污染空气、危害实验人员身体;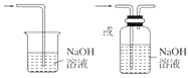 ;Cl2+2NaOH=NaCl+NaClO+H2O。
;Cl2+2NaOH=NaCl+NaClO+H2O。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 将NaHCO3溶液滴入Ca(ClO)2溶液中 | 出现沉淀 | Ka2(H2CO3)> Ka (HClO) |
B | 将湿润的KI-淀粉试纸置于集满红棕色气体的集气瓶口 | 试纸变蓝 | 该气体为Br2 |
C | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液 | 出现沉淀 | 沉淀只有AgBr |
D | 将石蜡油蒸汽通过炽热的碎瓷片,再将生成的气体通入溴的CCl4溶液中 | 溶液褪色 | 石蜡油催化裂解生成不饱和烃 |
A.AB.BC.CD.D