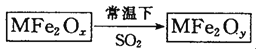题目内容
【题目】碘是人体必需的微量元素之一,我国以前在食盐中加KI加工碘盐。
(1) 目前加碘食盐中,不用KI的主要原因是__________________________。
(2) 将Fe3I8加入到K2CO3溶液中,生成Fe3O4、KI和一种气体,该反应的化学方程式为__________。
(3) 准确称取某KI样品3.500 0 g配制成100.00 mL溶液;取25.00 mL所配溶液置于锥形瓶中,加入15.00 mL 0.100 0 mol·L-1 K2Cr2O7酸性溶液(Cr2O72-转化为Cr3+),充分反应后,煮沸除去生成的I2;冷却后加入过量KI,用0.200 0 mol·L-1 Na2S2O3标准溶液滴定至终点(I2和S2O32-反应生成I-和S4O62-),消耗Na2S2O3标准溶液24.00 mL。计算该样品中KI的质量分数____________ (写出计算过程)。
【答案】KI易被氧化成I2而挥发 Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑ 由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-知,与过量KI反应的K2Cr2O7的物质的量:
n1(K2Cr2O7)=![]() n(S2O32-)=
n(S2O32-)=![]() ×0.200 0 mol·L-1×24.00 mL×10-3 L·mL-1
×0.200 0 mol·L-1×24.00 mL×10-3 L·mL-1
=8.000×10-4 mol
与样品中KI反应的K2Cr2O7的物质的量:
n2(K2Cr2O7)=0.100 0 mol·L-1×15.00 mL×10-3 L·mL-1-8.000×10-4 mol
=7.000×10-4 mol
500 0 g KI样品中所含KI的物质的量:
n(KI)=6n2(K2Cr2O7)×![]() =6×7.000×10-4 mol×4=1.680×10-2 mol
=6×7.000×10-4 mol×4=1.680×10-2 mol
w(KI)=![]() ×100%=79.68%
×100%=79.68%
【解析】
碘离子具有强的还原性,易被氧化;根据反应中没有化合价的升降和元素守恒得出另一种物质为含碳的化合物;根据题意加入过量重铬酸钾,移去单质碘,剩余的重铬酸钾与过量碘化钾反应,将生成的单质碘与Na2S2O3反应及量的关系得出过量重铬酸钾的物质的量,再计算原KI样品消耗的重铬酸钾的物质的量,再计算KI样品的物质的量和质量分数。
(1)目前加碘食盐中,不用KI的主要原因碘离子具有强的还原性,碘离子易被氧化成单质碘;故答案为:KI易被氧化成I2而挥发。
(2)将Fe3I8加入到K2CO3溶液中,生成Fe3O4、KI和一种气体,反应中没有化合价的升降,再根据元素守恒得出另一种物质为含碳的化合物即为二氧化碳,因此该反应的化学方程式为Fe3I8+4K2CO3 = Fe3O4+8KI+4CO2↑;故答案为:Fe3I8+4K2CO3 = Fe3O4+8KI+4CO2↑。
(3)由Cr2O72+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32 = 2I-+S4O62知,得出Cr2O72~3I2~6S2O32,与过量KI反应的K2Cr2O7的物质的量:n1(K2Cr2O7)=![]() n(S2O32)=
n(S2O32)=![]() ×0.200 0 mol·L1×24.00 mL×103 L·mL1=8.000×104 mol,与样品中KI反应的K2Cr2O7的物质的量:n2(K2Cr2O7)=0.100 0 mol·L1×15.00 mL×103 L·mL1-8.000×104 ml=7.000×104 mol,3.500 0 g KI样品中所含KI的物质的量:n(KI)=6n2(K2Cr2O7)×
×0.200 0 mol·L1×24.00 mL×103 L·mL1=8.000×104 mol,与样品中KI反应的K2Cr2O7的物质的量:n2(K2Cr2O7)=0.100 0 mol·L1×15.00 mL×103 L·mL1-8.000×104 ml=7.000×104 mol,3.500 0 g KI样品中所含KI的物质的量:n(KI)=6n2(K2Cr2O7)×![]() =6×7.000×104 mol×4=1.680×102 mol,
=6×7.000×104 mol×4=1.680×102 mol,![]() 。
。

 金钥匙试卷系列答案
金钥匙试卷系列答案