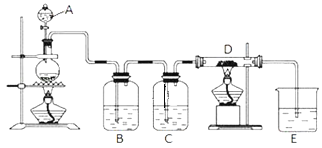
��Ŀ����
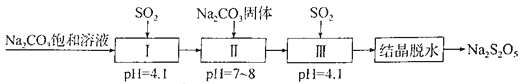
����Ŀ��Na2S2O5�dz��õķ�������Ư�����������̵����е�SO2����Na2S2O5�����������£�
����˵����ȷ����
A. �����Ʊ��������漰��������ֻ��һ������������
B. Na2S2O5����������SO2��Ư��ʱ�������ֻ�ԭ��
C. ���������е�Na2CO3������Һ��Na2CO3���岻�ɻ���
D. ʵ����ģ�����ᾧ��ˮ��ʱ�õ�������ֻ���������������ձ���©��
���𰸡�C
��������
����̼������Һ��ͨ���������ʹ��ҺpH��Ϊ4.1��˵����Һ�����ԣ�Na2CO3�Լ��ԣ�Na2SO3�Լ��ԣ�NaHCO3�Լ��ԣ���NaHSO3�����ԣ�˵����Ӧ������NaHSO3��ͬʱ�ų�������̼��I�е���ҺӦΪNaHSO3��Һ���ټ���Na2CO3���壬��NaHSO3ת��ΪNa2SO3���ٴγ���SO2����Na2SO3ת��ΪNaHSO3���õ������͵�NaHSO3��Һ����NaHSO3��������Һ�ᾧ��ˮ�Ƶ�Na2S2O5������2NaHSO3�TNa2S2O5+H2O���ݴ˷������
A�������Ʊ��������漰����������2������������������������Ͷ�����̼����A����
B��SO2��Ư��ʱ��δ����������ԭ��Ӧ��û�б��ֻ�ԭ�ԣ���B����
C�������������������������е�Na2CO3������Һ��Na2CO3���岻�ɻ���������ò��������͵�NaHSO3��Һ����C��ȷ��
D�� ���ᾧ��ˮ���Ǽ��ȹ���ֽ⣬Ӧ���������н��У���D����
��ѡC��

 ��ǰ����ϵ�д�
��ǰ����ϵ�д�