题目内容
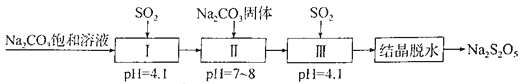
【题目】我国的矿产资源丰富。利用某冶炼废渣(主要成分为二氧化硅和锡、铜、铅、铁的氧化物)回收锡、铜、铅的工艺流程如下图所示:

回答下列问题:
(1)电炉冶炼时,焦炭的作用是________(填“氧化剂”或“还原剂”),将焦炭粉碎的目的是__________。熔剂的主要成分是氟石(CaF2),高温下能与SiO2反应生成两种钙盐,其中之一为 CaSiF6,该反应的化学方程式为____________________________。![]()
(2)脱铁后的溶液中含有少量的Sn2+,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为____________________________。
(3)已知SnO2不溶于稀硫酸。脱铁后氧化焙烧的目的是__________________。
(4)电解CuSO4溶液时,阳极的电极反应式为___________________________。
(5)已知H2CO3的一、二级电离常数分别为K1、K2,PbSO4、PbCO3的溶度积常数分别为Ksp(PbSO4)、Ksp(PbCO3)。锡、铅渣中的铅主要以PbSO4存在,脱硫时发生的反应为:
PbSO4(s)+HCO3ˉ(aq) ![]() PbCO3(s)+H+(aq)+SO42-(aq),该反应的平衡常数K=___________(用上述已知常数表示)。脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是_____________________________。
PbCO3(s)+H+(aq)+SO42-(aq),该反应的平衡常数K=___________(用上述已知常数表示)。脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是_____________________________。
(6)若该冶炼废渣中锡的质量分数为5%,30t废渣制得精锡lt,则锡的回收率为_____________________。
【答案】 还原剂 加快反应速率使反应更充分 3CaF2+3SiO2 ![]() CaSiF6+2CaSiO3 Sn2++Fe=Sn+Fe2+ 将Sn、Cu分别氧化为SnO2、CuO,利于浸铜时分离 2H2O-4e-=O2↑+4H+
CaSiF6+2CaSiO3 Sn2++Fe=Sn+Fe2+ 将Sn、Cu分别氧化为SnO2、CuO,利于浸铜时分离 2H2O-4e-=O2↑+4H+ ![]() 取少量末次洗涤液于试管中,滴加氯化钡溶液,若不出现浑浊,说明滤渣已洗净(合理答案均可) 66.7%
取少量末次洗涤液于试管中,滴加氯化钡溶液,若不出现浑浊,说明滤渣已洗净(合理答案均可) 66.7%
【解析】(1)电炉冶炼时,焦炭将金属氧化物还原产生合金,焦炭的作用是还原剂,将焦炭粉碎的目的是加快反应速率使反应更充分。熔剂的主要成分是氟石(CaF2),高温下能与SiO2反应生成两种钙盐,其中之一为 CaSiF6,该反应的化学方程式为3CaF2+3SiO2![]() CaSiF6+2CaSiO3;(2)脱铁后的溶液中含有少量的Sn2+,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,利用铁金属性强于锡置换出锡,反应的离子方程式为Sn2++Fe=Sn+Fe2+;(3)已知SnO2不溶于稀硫酸。脱铁后氧化焙烧的目的是将Sn、Cu分别氧化为SnO2、CuO,利于浸铜时分离;(4)电解CuSO4溶液时,阳极水电离出的氢氧根离子失电子产生氧气,反应的电极反应式为2H2O-4e-=O2↑+4H+;(5)已知H2CO3的一、二级电离常数分别为K1、K2,PbSO4、PbCO3的溶度积常数分别为Ksp(PbSO4)、Ksp(PbCO3)。锡、铅渣中的铅主要以PbSO4存在,脱硫时发生的反应为PbSO4(s)+HCO3ˉ(aq)
CaSiF6+2CaSiO3;(2)脱铁后的溶液中含有少量的Sn2+,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,利用铁金属性强于锡置换出锡,反应的离子方程式为Sn2++Fe=Sn+Fe2+;(3)已知SnO2不溶于稀硫酸。脱铁后氧化焙烧的目的是将Sn、Cu分别氧化为SnO2、CuO,利于浸铜时分离;(4)电解CuSO4溶液时,阳极水电离出的氢氧根离子失电子产生氧气,反应的电极反应式为2H2O-4e-=O2↑+4H+;(5)已知H2CO3的一、二级电离常数分别为K1、K2,PbSO4、PbCO3的溶度积常数分别为Ksp(PbSO4)、Ksp(PbCO3)。锡、铅渣中的铅主要以PbSO4存在,脱硫时发生的反应为PbSO4(s)+HCO3ˉ(aq) ![]() PbCO3(s)+H+(aq)+SO42+(aq),该反应的平衡常数K=
PbCO3(s)+H+(aq)+SO42+(aq),该反应的平衡常数K=![]() ;检验滤渣是否洗涤干净是检验洗涤液中是否含有硫酸根离子,检验的方法是取少量末次洗涤液于试管中,滴加氯化钡溶液,若不出现浑浊,说明滤渣已洗净;(6)若该冶炼废渣中锡的质量分数为5%,30t废渣制得精锡lt,则锡的回收率为
;检验滤渣是否洗涤干净是检验洗涤液中是否含有硫酸根离子,检验的方法是取少量末次洗涤液于试管中,滴加氯化钡溶液,若不出现浑浊,说明滤渣已洗净;(6)若该冶炼废渣中锡的质量分数为5%,30t废渣制得精锡lt,则锡的回收率为![]() 。
。

【题目】下表列出了①~⑩10种元素在周期表中的位置。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,最不活泼的是(填元素符号,下同)________,金属性最强的是________,③④⑤三种元素的原子半径由大到小的顺序是________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式,下同),呈两性的氢氧化物是________。
(4)比较⑥和⑦氢化物的稳定性由强到弱的顺序是_______(填化学式)。
【题目】“铝热反应”的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是________________________________________________________________________。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:_____________________。
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,当观察到________时,说明熔融物中含有金属铝。
(4)实验室溶解该熔融物,最好选用下列试剂中的____(填字母),理由是__________。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液