题目内容
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g) + H2(g) ΔH1已知:②C4H10(g) +![]() O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) +
O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) + ![]() O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
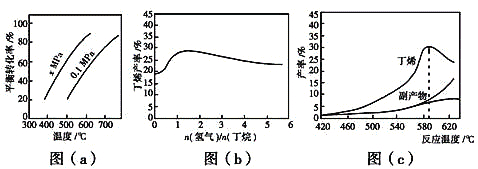
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是______________________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。590 ℃之后,丁烯产率快速降低的主要原因是_____________。
【答案】+123 小于 AD 氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大,故丁烯产率下降 丁烯高温裂解生成短链烃类
【解析】
本题考查的是用盖斯定律进行有关反应热的计算、化学平衡的影响因素。
①根据盖斯定律,②式-③式可得①式的△H1;
②由图(a)定温度,压强由0.1MPa变化到xMPa,丁烷的转化率增大,即平衡正向移动,结合反应前后气体体积的变化分析x;
③要使丁烯的平衡产率增大,需通过改变温度和压强使平衡正向移动;丁烷分解产生丁烯和氢气,增加氢气的量会促使平衡逆向移动,丁烯的产率下降;由题中信息可知丁烷高温会裂解生成短链烃类,所以当温度超过590℃时,部分丁烷裂解导致产率降低。
(1)②C4H10(g)+1/2O2(g)=C4H8(g)+H2O(g)△H2=119kJmol1
③H2(g)+1/2O2(g)=H2O(g)△H3=242kJmol1
②③得C4H10(g)=C4H8(g)+H2(g)△H1=+123kJmol1;
由图(a)可知温度相同时,由0.1MPa变化到xMPa,丁烷转化率增大,即平衡正向移动,该反应是气体体积增大的反应,所以x的压强更小,x<0.1; 由于反应①为吸热反应,温度升高时,平衡正向移动,丁烯的平衡产率增大,反应①正向进行时体积增大,减压时平衡正向移动,丁烯的平衡产率增大,因此AD正确。本小题答案为:+123;小于;AD。
(2)丁烷分解产生丁烯和氢气,一开始充入氢气是活化催化剂,同时氢气作为反应①的产物,增大氢气的量会促使平衡逆向移动,从而减少平衡体系中的丁烯的含量,使丁烯的产率降低。本小题答案为:氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大,故丁烯产率下降。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。温度超过590℃时,由于丁烷高温会裂解生成短链烃类,所以参加反应①的丁烷也就相应减少,产率下降。本小题答案为:丁烯高温裂解生成短链烃类。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】下表列出了①~⑩10种元素在周期表中的位置。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,最不活泼的是(填元素符号,下同)________,金属性最强的是________,③④⑤三种元素的原子半径由大到小的顺序是________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式,下同),呈两性的氢氧化物是________。
(4)比较⑥和⑦氢化物的稳定性由强到弱的顺序是_______(填化学式)。