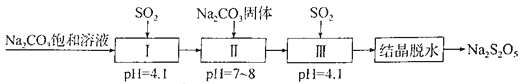
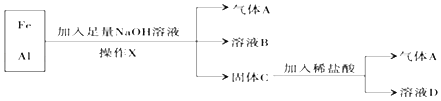
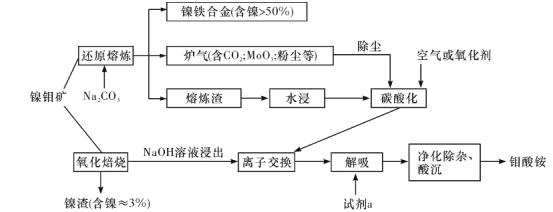
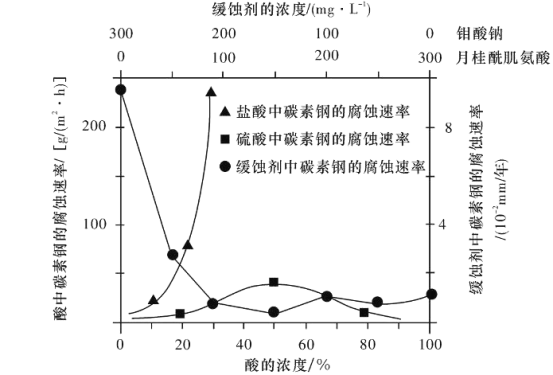
题目内容
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D (放置有铁粉 )。请回答:
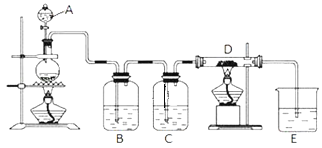
(1)烧瓶中反应的化学方程式是_____;
(2)装置B中盛放液体是_____,气体通过装置B的目的是_____;装置C中盛放的液体是_____,气体通过装置C的目的是_____;
(3)烧杯E中盛放的液体是_____;
(4)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O (g )剧烈反应;为收集D中产物,在D与E之间,除增加收集装置外,还需要增加_____装置;
(5)当电子转移的数目为6.02×1023个时生成的氯气的物质的量为_____mol,生成的氯气需用0.5mol/L的NaOH溶液_____L完全吸收。
【答案】MnO2+4HCl (浓)![]() MnCl2+Cl2↑+2H2O 饱和NaCl溶液 吸收氯气中混有的杂质HCl 浓硫酸 干燥氯气 NaOH溶液 干燥 0.5 2
MnCl2+Cl2↑+2H2O 饱和NaCl溶液 吸收氯气中混有的杂质HCl 浓硫酸 干燥氯气 NaOH溶液 干燥 0.5 2
【解析】
实验室用加热二氧化锰与浓盐酸方法制取氯气,因为浓盐酸具有挥发性,所以制备的氯气中含有氯化氢和水蒸气,要得到纯净的氯气,应除去氯化氢和水蒸气,可以依次通过盛有饱和食盐水、浓硫酸的洗气瓶进行除杂,氯气与铁在加热条件下反应生成氯化铁,氯气有毒,直接排放到空气中能够污染空气,应进行尾气处理,据此分析解答。
(1)实验室用加热二氧化锰与浓盐酸方法制取氯气,二者加热生成氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl (浓) ![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl (浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl (浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,所以制备的氯气中含有氯化氢和水蒸气,要得到纯净的氯气,应除去氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以选择盛有饱和食盐水的B装置除去氯化氢,浓硫酸具有吸水性,可以干燥氯气,所以选择盛有浓硫酸的洗气瓶C除去水蒸气,故答案为:饱和NaCl溶液; 吸收氯气中混有的杂质HCl;浓硫酸;干燥氯气;
(3)氯气有毒,直接排放到空气中能够污染空气,应进行尾气处理,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,可以选择氢氧化钠溶液吸收过量的氯气,故答案为:NaOH溶液;
(4)生成的氯化铁:①受热易升华,冷却后易凝华;②遇H2O (g )剧烈反应,需要防止水蒸气进入装置D,为收集D中产物,在D与E之间,除增加收集装置外,还需要增加干燥装置,防止装置E中水蒸气进入,故答案为:干燥;
(5)依据方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,生成1mol氯气转移2mol电子,则当电子转移的数目为6.02×1023个物质的量为1mol时,生成的氯气的物质的量为0.5mol,依据2NaOH+Cl2═NaCl+H2O+NaClO,0.5mol氯气消耗氢氧化钠1mol,用0.5mol/L的NaOH溶液体积为2L,故答案为: 0.5; 2.
MnCl2+Cl2↑+2H2O,生成1mol氯气转移2mol电子,则当电子转移的数目为6.02×1023个物质的量为1mol时,生成的氯气的物质的量为0.5mol,依据2NaOH+Cl2═NaCl+H2O+NaClO,0.5mol氯气消耗氢氧化钠1mol,用0.5mol/L的NaOH溶液体积为2L,故答案为: 0.5; 2.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案