题目内容
6.能说明氯的非金属性比硫强的事实是( )| A. | HCl是强酸而H2SO3是弱酸 | B. | HClO4的酸性比H2SO4强 | ||
| C. | H2S比HCl稳定 | D. | H2SO4比HClO酸性强 |
分析 比较非金属性可通过以下角度:①氢化物的稳定性,②与氢气反应的难易程度,③最高价氧化物对应的水化物的酸性,④单质之间的置换反应,⑤对应阴离子的还原性强弱,⑥与变价金属反应的化合价高低等.
解答 解:A、比较非金属性的强弱是通过元素最高价氧化物对应的水化物来比较的,而不是比较无氧酸和低价氧化物对应的水化物,故A错误;
B、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,HClO4的酸性比H2SO4强,说明氯的非金属性强于硫的非金属性,故B正确;
C、元素的非金属性越强,对应的氢化物越稳定,如果H2S比HCl稳定,则硫的非金属性强于氯,故C错误;
D、应比较最高价氧化物对应的水化物,而次氯酸是低价氧化物,故D错误;
故选B.
点评 本题考查非金属性的比较,学习中注意把握比较非金属性强弱的角度,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
5.相同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件下的最佳组合是( )
①纯锌片
②粗锌粒
③0.1mol•L-1硫酸
④98%的浓硫酸
⑤加热
⑥用冰水冷却.
①纯锌片
②粗锌粒
③0.1mol•L-1硫酸
④98%的浓硫酸
⑤加热
⑥用冰水冷却.
| A. | ①④⑤ | B. | ②③⑤ | C. | ①③⑥ | D. | ②④⑤ |
6.有关下列两种溶液的说法中,不正确的是( )
①0.2mo1•L-1 CH3COONa溶液 ②0.1mo1•L-1H2SO4溶液.
①0.2mo1•L-1 CH3COONa溶液 ②0.1mo1•L-1H2SO4溶液.
| A. | 相同温度下,溶液中水的电离程度:①>② | |
| B. | 向①加水后所得溶液c(CH3COO-)/c(CH3COOH)的比值变大 | |
| C. | 等体积混合溶液①和溶液②,所得溶液中2c(SO42-)=c(Na+) | |
| D. | 25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(CH3COO-)+c(SO42-) |
14.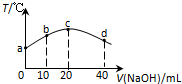 若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
 若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-) | |
| C. | c点混合溶液中:c(OH-)>c(HNO2) | |
| D. | d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+) |
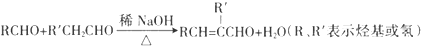
 .
. .
. 在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断
在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断 E.
E.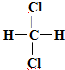 和
和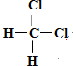
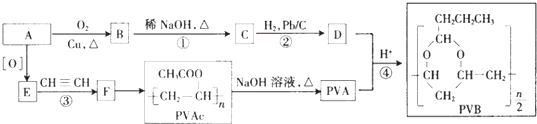
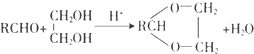
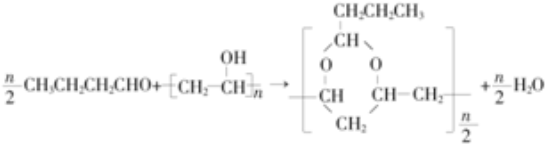
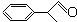 )曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题:
)曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题: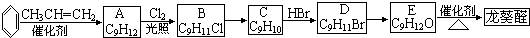
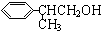 +O2
+O2
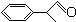 +2H2O.
+2H2O. 、
、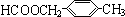 .
.