题目内容
6.有关下列两种溶液的说法中,不正确的是( )①0.2mo1•L-1 CH3COONa溶液 ②0.1mo1•L-1H2SO4溶液.
| A. | 相同温度下,溶液中水的电离程度:①>② | |
| B. | 向①加水后所得溶液c(CH3COO-)/c(CH3COOH)的比值变大 | |
| C. | 等体积混合溶液①和溶液②,所得溶液中2c(SO42-)=c(Na+) | |
| D. | 25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(CH3COO-)+c(SO42-) |
分析 A、溶液①是强碱弱酸盐溶液,醋酸根离子水解显碱性,促进水的电离;溶液②是酸溶液,对水的电离起到抑制作用;
B、加水稀释促进醋酸根离子的水解,但不改变水解平衡常数;
C、溶液①和溶液②等体积混合恰好反应生成醋酸和硫酸钠,根据硫酸钠中钠离子与硫酸根离子的组成确定两者的关系;
D、25℃时,溶液混合后PH=7,溶液呈中性,依据溶液中电荷守恒分析判断;
解答 解:A、溶液①是强碱弱酸盐溶液,醋酸根离子水解显碱性,促进水的电离:溶液②是酸溶液,对水的电离起到抑制作用;相同温度下,溶液中水的电离程度:溶液①>溶液②,故A正确;
B、加水稀释促进醋酸根离子的水解,所以溶液中c(CH3COO-)/c(CH3COOH)变小,故B错误;
C、溶液①和溶液②等体积混合恰好反应生成醋酸和硫酸钠,所以得溶液中2c(SO42-)=c(Na+),故C正确;
D、25℃时,溶液混合后PH=7,溶液呈中性,溶液中存在电荷守恒;[Na+]+[H+]=[OH-]+[CH3COO-]+2[SO42-],[H+]=[OH-],c[CH3COO-]+2[SO42-]=[Na+],溶液中c(Na+)>c(CH3COO-)+c(SO42-),故D正确;
故选B.
点评 本题考查了影响水的电离平衡的影响因素,盐类水解的水解常数的分析应用,溶液中的电荷守恒应用,两种浓度大小比较的方法,题目难度中等.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
16.下列各装置能够达到相应实验目的是( )
| A. | 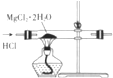 制取无水MgCl2 | B. |  除去CO2气体中的HCl气体 | ||
| C. | 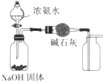 制取并收集干燥纯净的NH3 | D. | 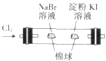 证明氧化性:Cl2>Br2>I2 |
17.下列有关物质结构的表述正确的是( )
| A. | H2O2的电子式: | B. | CO2的比例模型: | ||
| C. | 14C的原子结构示意图: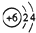 | D. | CCl4的结构式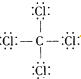 |
14.化学与人类生活密切相关,下列与化学有关的说法正确的是( )
| A. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| B. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| C. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| D. | 石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
1.化学在生产和生活中有重要的应用.下列说法正确的是( )
| A. | 次氯酸钠是漂粉精的主要成分 | |
| B. | 氧化钠可用于呼吸面具 | |
| C. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
9.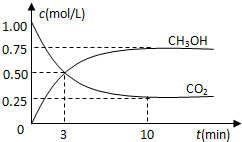 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 进行到3分钟时,正反应速率和逆反应速率相等 | |
| B. | 10分钟后容器中各物质浓度不再改变 | |
| C. | 达到平衡后,升高温度,正反应速率增大、逆反应速率减小 | |
| D. | 3min前v正>v逆,3min后v正<v逆 |
6.能说明氯的非金属性比硫强的事实是( )
| A. | HCl是强酸而H2SO3是弱酸 | B. | HClO4的酸性比H2SO4强 | ||
| C. | H2S比HCl稳定 | D. | H2SO4比HClO酸性强 |
 +(CH3CO)2O→
+(CH3CO)2O→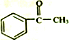 +CH3COOH
+CH3COOH ;B
;B .
. 直接制取
直接制取 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.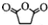 +
+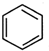 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$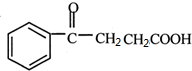 .
. .
.