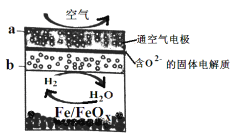
题目内容
【题目】下列有关电池的叙述正确的是( )
A. 手机上用的锂电池属于一次电池
B. 锌锰干电池中,为了延长电池寿命,可将NH4Cl换成KOH
C. 甲烷燃料电池工作时甲烷在负极被还原
D. 太阳能电池的主要材料为二氧化硅
【答案】B
【解析】A、锂电池是二次电池不是一次电池,故A错误;B、NH4Cl是强酸弱碱盐水解呈酸性,金属材料在碱性电解质中稳定,MH4Cl换成KOH电池使用寿命更长,故B正确;C、 甲烷燃料电池工作时甲烷在负极被氧化,故C错误;D、太阳能电池的主要材料为硅,故D错误;故选B。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】PCl3可用于半导体生产的外延、扩散工序,有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 |
PCl3 | —112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
(一)制备:RU 图是实验室制备PCl3的装置(部分仪器已省略)

(1)仪器乙的名称___________。
(2)实验室用漂白粉加浓盐酸制备Cl2的化学方程式:__________ 。
(3)碱石灰的作用是__________、___________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一 段时间的CO2,其目的是________。
(二)提纯:
(5)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过________(填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取4.200 g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的0.1000 mol/L 20.00 mL 碘溶液,充分反应后再用0.1000 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗10.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为______________。若滴定终点时俯视读数,则PCl3的质量分数_________(偏大、偏小、或无影响)。