��Ŀ����
����Ŀ��PCl3�����ڰ뵼�����������ӡ���ɢ�����й����ʵIJ����������£�
�۵�/�� | �е�/�� | �ܶ�/g��mL��1 | ���� | |
���� | 44.1 | 280.5 | 1.82 | 2P(����)+3Cl2 |
PCl3 | ��112 | 75.5 | 1.574 | ��ˮ����H3PO3��HCl����O2����POCl3 |
POCl3 | 2 | 105.3 | 1.675 | ��ˮ����H3PO4��HCl��������PCl3 |
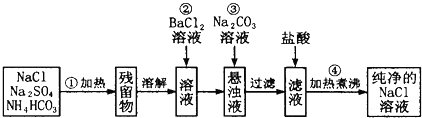
��һ���Ʊ���RU ͼ��ʵ�����Ʊ�PCl3��װ�ã�����������ʡ�ԣ�
��1�������ҵ�����___________��
��2��ʵ������Ư�ۼ�Ũ�����Ʊ�Cl2�Ļ�ѧ����ʽ��__________ ��
��3����ʯ�ҵ�������__________��___________��
��4������������ͨ�����Cl2֮ǰ��Ӧ��ͨ��һ ��ʱ���CO2����Ŀ����________��
�������ᴿ��
��5���ֲ�Ʒ�г�����POCl3��PCl5�ȡ���������ȳ�ȥPCl5��ͨ��________����ʵ��������ƣ������ɵõ�PCl3�Ĵ�Ʒ��
������������
�ⶨ��Ʒ��PCl3���ȵķ������£�Ѹ�ٳ�ȡ4.200 g��Ʒ��ˮ����ȫ�����500mL��Һ��ȡ��25.00mL���������0.1000 mol/L 20.00 mL ����Һ����ַ�Ӧ������0.1000 mol/L Na2S2O3��Һ�ζ������ĵ⣬�յ�ʱ����10.00 mL Na2S2O3��Һ��
��֪��H3PO3+H2O+I2=H3PO4+2HI��I2+2Na2S2O3=2NaI+Na2S4O6������ⶨ������û��������Ӧ��
��6�������������ݣ��ò�Ʒ��PCl3����������Ϊ______________�����ζ��յ�ʱ���Ӷ�������PCl3����������_________(ƫ��ƫС������Ӱ��)��
���𰸡� ������ Ca(ClO)2��4HCl = CaCl2��2H2O +2Cl2�� ���ն����Cl2����ֹ��Ⱦ���� ��ֹ�����е�ˮ�ֽ��룬Ӱ���Ʒ���� �ž�װ���еĿ�������ֹO2��ˮ��PCl3��Ӧ ���� 98��21% ƫ��
����������1���������������֪����������Ϊ�����ܣ���2��ʵ������Ư�ۼ�Ũ�����Ʊ�Cl2�Ļ�ѧ����ʽΪCa(ClO)2��4HCl��CaCl2��2H2O +2Cl2������3�������ж�����Ⱦ��������ʯ�����ն���������ֹ��Ⱦ������ͬʱ��ֹ�����е�ˮ��������Ӱ���Ʒ���ȣ���4������PCl3��O2������POCl3����ˮ����H3PO3��HCl��ͨ��һ��ʱ���CO2�����ž�װ���еĿ�������ֹ���ɵ�PCl3������е�O2��ˮ��Ӧ����Ŀ�����ž�װ���еĿ�������ֹ�����е�ˮ�ֺ�������PCl3��Ӧ����5���������ʵķе���ֵ��ͬ��������������ķ�����������Ȼ��ף���6�����ݷ�ӦH3PO3+H2O+I2��H3PO4+2HI��I2+2Na2S2O3��2NaI+Na2S4O6��֪H3PO3���ʵ�����PCl3�����ʵ�����ͬ��25mL��Һ�к�H3PO3��Ӧ�ĵⵥ�����ʵ���Ϊ0.02L��0.100mol/L��0.01L��0.100mol/L��1/2��0.0015mol������500mL��Һ��H3PO3���ʵ�����0.03mol����ò�Ʒ��PCl3����������Ϊ![]() �����ζ��յ�ʱ���Ӷ���������ƫС�����ı�Һ������٣�����H3PO3���������ӣ�����PCl3����������ƫ��
�����ζ��յ�ʱ���Ӷ���������ƫС�����ı�Һ������٣�����H3PO3���������ӣ�����PCl3����������ƫ��

����Ŀ��Ŀǰ��ҵ�Ͽ�����CO��CO2������ȼ�ϼ״���ij�о�С��������йؼ״���ȡ��������ѧ��Ӧԭ������̽������֪�ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ��(K1��K2��K3)���±���ʾ��
��ѧ��Ӧ | �ʱ� | ƽ�ⳣ�� | �¶�/�� | ||
500 | 700 | 800 | |||
��2H2(g)��CO(g) | ��H1 | K1 | 2.5 | 0.34 | 0.15 |
��CO2(g)��H2(g) | ��H2 | K2 | 1.0 | 1.70 | 2.52 |
��CO2(g)��3H2(g) | ��H3 | K3 | |||
��ش��������⣺
(1)��Ӧ����________(��������������������)��Ӧ��
(2)���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3��________(��K1��K2��ʾ)�����ݷ�Ӧ���ж���S___0(����>��������������<��)����______(�����ϸ��������ϵ���)�¶��������ڸ÷�Ӧ�Է����С�
(3)500��ʱ����÷�Ӧ����ijʱ�̣�CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ�ȷֱ�Ϊ0.1mol/L��0.8mol/L��0.3mo/L��0.15mol/L�����ʱv��________v��(����>��������������<��)��
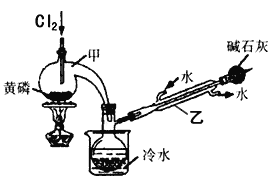
����Ŀ��ij̽��С���ò���HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����ء�����HNO3Ũ��Ϊ1.00 mol/L��2.00 mol/L������ʯ��ϸ������ֿ������ֹ��ʵ���¶�Ϊ298 K��308 K��ÿ��ʵ��HNO3��Һ������Ϊ25.0 mL������ʯ����Ϊ10.00 g��
(1)���������ʵ����Ʊ�������ʵ��Ŀ��һ���������Ӧ��ʵ���ţ�
ʵ���� | T(K) | ����ʯ��� | HNO3Ũ��(mol/L) | ʵ��Ŀ�� |
�� | 298 | �ֿ��� | 2.00 | (I)ʵ��ٺ͢�̽��HNO3Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�� (II)ʵ��ٺ�____̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻 (III)ʵ��ٺ�____̽������ʯ���(�֡�ϸ)�Ը÷�Ӧ���ʵ�Ӱ�졣 |
�� | _____ | _______ | __________ | |
�� | _____ | _______ | __________ | |
�� | _____ | _______ | __________ |
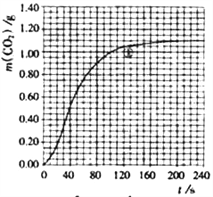
(2)ʵ������CO2������ʱ��仯�Ĺ�ϵ����ͼ�����ݷ�Ӧ����ʽ![]() CaCO3+HNO3=
CaCO3+HNO3=![]() Ca(NO3)2+
Ca(NO3)2+![]() CO2��+
CO2��+![]() H2O������ʵ������70-90 s��Χ��HNO3��ƽ����Ӧ����____________��д���������[������Һ����仯����70sʱm(CO2)=0.84g��90sʱm(CO2)=0.95g]��
H2O������ʵ������70-90 s��Χ��HNO3��ƽ����Ӧ����____________��д���������[������Һ����仯����70sʱm(CO2)=0.84g��90sʱm(CO2)=0.95g]��