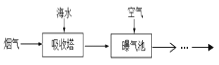
ЬтФПФкШн
ЁОЬтФПЁПЪЕбщЪвгУТШЫсМиКЭЖўбѕЛЏУЬжЦШЁбѕЦјЕФЗДгІЗНГЬЪНЮЊЃК2KClO3 ![]() 2KCl+3O2Ёќ
2KCl+3O2Ёќ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉИУЗДгІжаБЛбѕЛЏЕФдЊЫиУћГЦЮЊ ЃЌ ЩњГЩ1mol O2ЪБзЊвЦЕчзгЕФЪ§ФПЪЧ ЃЎ
ЃЈ2ЃЉДгЗДгІКѓЕФЙЬЬхЛьКЯЮяжаЗжРыГіФбШмгкЫЎЕФMnO2ЕФОпЬхЪЕбщВйзїУћГЦЃК ЃЎ
ЃЈ3ЃЉЗжРыГіЕФMnO2ПЩгУгкЪЕбщЪвжЦШЁCl2 ЃЌ ЛЏбЇЗНГЬЪНЮЊЃКMnO2+4HClЃЈХЈЃЉ ![]() MnCl2+Cl2Ёќ+2H2OЃЌЦфРызгЗНГЬЪНЮЊ ЃЎ
MnCl2+Cl2Ёќ+2H2OЃЌЦфРызгЗНГЬЪНЮЊ ЃЎ
ЃЈ4ЃЉШєСНИіЗДгІжазЊвЦЕФЕчзгЕФЮяжЪЕФСПЯрЭЌЃЌдђЩњГЩЕФO2КЭCl2дкЯрЭЌзДПіЯТЕФЬхЛ§БШЮЊ
ЃЈ5ЃЉвдЩЯСНИіЗДгІЖМгУЕНMnO2 ЃЌ ЦфзїгУЗжБ№ЪЧЁЂ ЃЎ
ЁОД№АИЁП
ЃЈ1ЃЉбѕЃЛ4NA
ЃЈ2ЃЉЙ§ТЫ
ЃЈ3ЃЉMnO2+4H++2ClЉ ![]() Mn2++Cl2Ёќ+2H2O
Mn2++Cl2Ёќ+2H2O
ЃЈ4ЃЉ1ЃК6
ЃЈ5ЃЉДпЛЏМСЃЛбѕЛЏМС
ЁОНтЮіЁПНтЃКЃЈ1ЃЉЗДгІжабѕдЊЫиЛЏКЯМлЩ§ИпЃЌдЊЫиБЛбѕЛЏЃЌЩњГЩ3mol O2ЪБзЊвЦЕчзг12molЃЌЕУЕНЩњГЩ1mol O2ЪБзЊвЦЕчзгЕФЪ§ФПЪЧ4NAЃЛЙЪД№АИЮЊЃКбѕЃЛ4NAЃЛЃЈ2ЃЉЗжРыГіЙЬвКЛьКЯЮяВЩгУЙ§ТЫЕФЗНЗЈЃЌДгЗДгІКѓЕФЙЬЬхЛьКЯЮяжаЗжРыГіФбШмгкЫЎЕФMnO2ЕФЗНЗЈЪЧЙ§ТЫЃЌЙЪД№АИЮЊЃКЙ§ТЫЃЛЃЈ3ЃЉбЮЫсЁЂТШЛЏУЬПЩвдВ№ГЩРызгЕФаЮЪНЃЌОнДЫЪщаДРызгЗНГЬЪНЮЊЃКMnO2+4H++2ClЉ ![]() Mn2++Cl2Ёќ+2H2OЃЌЙЪД№АИЮЊЃКMnO2+4H++2ClЉ
Mn2++Cl2Ёќ+2H2OЃЌЙЪД№АИЮЊЃКMnO2+4H++2ClЉ ![]() Mn2++Cl2Ёќ+2H2OЃЛЃЈ4ЃЉ2KClO3
Mn2++Cl2Ёќ+2H2OЃЛЃЈ4ЃЉ2KClO3 ![]() 2KCl+3O2ЁќзЊвЦЕчзг12molЩњГЩбѕЦјЪЧ3molЃЌMnO2+4HClЃЈХЈЃЉ
2KCl+3O2ЁќзЊвЦЕчзг12molЩњГЩбѕЦјЪЧ3molЃЌMnO2+4HClЃЈХЈЃЉ ![]() MnCl2+Cl2Ёќ+2H2OзЊвЦЕчзг2molЃЌВњЩњТШЦјЪЧ1molЃЌШєСНИіЗДгІжазЊвЦЕФЕчзгЕФЮяжЪЕФСПЯрЭЌЃЌЩњГЩЕФO2КЭCl2дкЯрЭЌзДПіЯТЕФЬхЛ§БШЕШгкЮяжЪЕФСПжЎБШМДЮЊ1ЃК6ЃЛЙЪД№АИЮЊЃК1ЃК6ЃЛЃЈ5ЃЉ2KClO3
MnCl2+Cl2Ёќ+2H2OзЊвЦЕчзг2molЃЌВњЩњТШЦјЪЧ1molЃЌШєСНИіЗДгІжазЊвЦЕФЕчзгЕФЮяжЪЕФСПЯрЭЌЃЌЩњГЩЕФO2КЭCl2дкЯрЭЌзДПіЯТЕФЬхЛ§БШЕШгкЮяжЪЕФСПжЎБШМДЮЊ1ЃК6ЃЛЙЪД№АИЮЊЃК1ЃК6ЃЛЃЈ5ЃЉ2KClO3 ![]() 2KCl+3O2ЁќжаЖўбѕЛЏУЬЪЧДпЛЏМСЃЌMnO2+4HClЃЈХЈЃЉ
2KCl+3O2ЁќжаЖўбѕЛЏУЬЪЧДпЛЏМСЃЌMnO2+4HClЃЈХЈЃЉ ![]() MnCl2+Cl2Ёќ+2H2OжаЖўбѕЛЏУЬЪЧбѕЛЏМСЃЌЙЪД№АИЮЊЃКДпЛЏМСЃЛбѕЛЏМСЃЎ
MnCl2+Cl2Ёќ+2H2OжаЖўбѕЛЏУЬЪЧбѕЛЏМСЃЌЙЪД№АИЮЊЃКДпЛЏМСЃЛбѕЛЏМСЃЎ
ЃЈ1ЃЉЛЏКЯМлЩ§ИпдЊЫиБЛбѕЛЏЃЌИљОнЛЏКЯМлБфЛЏШЗЖЈЕчзгзЊвЦЧщПіЃЛЃЈ2ЃЉЗжРыГіЙЬвКЛьКЯЮяВЩгУЙ§ТЫЕФЗНЗЈЃЛЃЈ3ЃЉбЮЫсЁЂТШЛЏУЬПЩвдВ№ГЩРызгЕФаЮЪНЃЌОнДЫЪщаДРызгЗНГЬЪНЃЛЃЈ4ЃЉЩњГЩЕФO2КЭCl2дкЯрЭЌзДПіЯТЕФЬхЛ§БШЕШгкЮяжЪЕФСПжЎБШЃЛЃЈ5ЃЉИљОнЖўбѕЛЏУЬЪЧВЛВЮгыЛЏбЇЗДгІЕФЬиЕуРДЛиД№ЃЎ

 гІгУЬтзївЕБОЯЕСаД№АИ
гІгУЬтзївЕБОЯЕСаД№АИЁОЬтФПЁПФГЬНОПаЁзщгУВтСПHNO3гыДѓРэЪЏЗДгІЙ§ГЬжажЪСПМѕаЁЕФЗНЗЈЃЌбаОПгАЯьЗДгІЫйТЪЕФвђЫиЁЃЫљгУHNO3ХЈЖШЮЊ1.00 mol/LЁЂ2.00 mol/LЃЌДѓРэЪЏгаЯИПХСЃгыДжПХСЃСНжжЙцИёЃЌЪЕбщЮТЖШЮЊ298 KЁЂ308 KЃЌУПДЮЪЕбщHNO3ШмвКЕФгУСПЮЊ25.0 mLЁЂДѓРэЪЏгУСПЮЊ10.00 gЁЃ
(1)ЧыЭъГЩвдЯТЪЕбщЩшМЦБэЃЌВЂдкЪЕбщФПЕФвЛРИжаЬюГіЖдгІЕФЪЕбщБрКХЃК
ЪЕбщБрКХ | T(K) | ДѓРэЪЏЙцИё | HNO3ХЈЖШ(mol/L) | ЪЕбщФПЕФ |
Ђй | 298 | ДжПХСЃ | 2.00 | (I)ЪЕбщЂйКЭЂкЬНОПHNO3ХЈЖШЖдИУЗДгІЫйТЪЕФгАЯь (II)ЪЕбщЂйКЭ____ЬНОПЮТЖШЖдИУЗДгІЫйТЪЕФгАЯьЃЛ (III)ЪЕбщЂйКЭ____ЬНОПДѓРэЪЏЙцИё(ДжЁЂЯИ)ЖдИУЗДгІЫйТЪЕФгАЯьЁЃ |
Ђк | _____ | _______ | __________ | |
Ђл | _____ | _______ | __________ | |
Ђм | _____ | _______ | __________ |
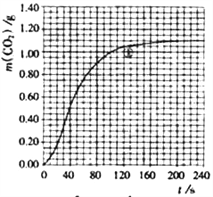
(2)ЪЕбщЂйжаCO2жЪСПЫцЪБМфБфЛЏЕФЙиЯЕМћЯТЭМЃКвРОнЗДгІЗНГЬЪН![]() CaCO3+HNO3=
CaCO3+HNO3=![]() Ca(NO3)2+
Ca(NO3)2+![]() CO2Ёќ+
CO2Ёќ+![]() H2OЃЌМЦЫуЪЕбщЂйдк70-90 sЗЖЮЇФкHNO3ЕФЦНОљЗДгІЫйТЪ____________ЃЌаДГіМЦЫуЙ§ГЬ[КіТдШмвКЬхЛ§БфЛЏЃЌЧв70sЪБm(CO2)=0.84gЃЌ90sЪБm(CO2)=0.95g]ЁЃ
H2OЃЌМЦЫуЪЕбщЂйдк70-90 sЗЖЮЇФкHNO3ЕФЦНОљЗДгІЫйТЪ____________ЃЌаДГіМЦЫуЙ§ГЬ[КіТдШмвКЬхЛ§БфЛЏЃЌЧв70sЪБm(CO2)=0.84gЃЌ90sЪБm(CO2)=0.95g]ЁЃ
ЁОЬтФПЁПдк1.0LУмБеШнЦїжаЗХШы0.10molA(g)ЃЌдквЛЖЈЮТЖШНјааШчЯТЗДгІЃКA(g)![]() B(g)+C(g) ЁїH ЃН+85.1kJ/mol ЗДгІЪБМф(t)гыШнЦїФкзмбЙЧП(P)ЕФЪ§ОнМћЯТБэЃК
B(g)+C(g) ЁїH ЃН+85.1kJ/mol ЗДгІЪБМф(t)гыШнЦїФкзмбЙЧП(P)ЕФЪ§ОнМћЯТБэЃК
ЪБМфt/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
змбЙЧПP/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
МЦЫуЦНКтЪБAЕФзЊЛЏТЪ__________КЭЦНКтГЃЪ§___________________ЁЃ