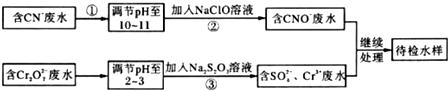
题目内容
18.下列对于铯(Cs)的性质的预测中,正确的是( )| A. | 它只有一种氧化物Cs2O | B. | 它与水剧烈反应 | ||
| C. | Cs+具有很强的氧化性 | D. | CsHCO3受热不易分解 |
分析 Cs位于第六周期第IA族,属于碱金属族元素,其金属性大于Na,
A.Cs能和氧气反应生成复杂的含氧化合物;
B.金属的金属性越强,其与水或酸反应越剧烈;
C.元素的金属性越强,其简单阳离子的氧化性越弱;
D.碱金属族碳酸氢盐不稳定,受热易分解.
解答 解:Cs位于第六周期第IA族,属于碱金属族元素,其金属性大于Na,
A.金属性Cs>Na,Na和氧气反应都生成过氧化钠,则Cs能和氧气反应生成复杂的含氧化合物,故A错误;
B.金属的金属性越强,其与水或酸反应越剧烈,金属性Cs>Na,Na和水反应较剧烈,则Cs和水反应更剧烈,故B正确;
C.元素的金属性越强,其简单阳离子的氧化性越弱,金属性Cs>Na,所以Cs+没有很强的氧化性,故C错误;
D.碱金属族碳酸氢盐不稳定,受热易分解,所以CsHCO3受热易分解,故D错误;
故选B.
点评 本题以Cs为例考查碱金属元素性质递变规律,侧重考查元素周期律及学生知识迁移能力,知道金属的金属性强弱判断方法,采用知识迁移及对比的方法进行解答即可,题目难度不大.

练习册系列答案
相关题目
8.关于钠及其化合物性质的叙述,正确的是( )
| A. | 相同条件下,在水中碳酸钠的溶解度小于碳酸氢钠的溶解度 | |
| B. | 氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同 | |
| C. | 碳酸氢钠固体中混有少量碳酸钠,可用加热的方法除去 | |
| D. | 质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,后者产生气体多 |
9.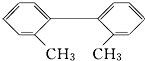 已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
 已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃苯环上的一氯取代物最多有四种 | |
| D. | 该烃是苯的同系物 |
6.等物质的量的Na、Mg、Al分别与等物质的量的盐酸(1mol)反应生成H2,产生H2体积大小(相同状况)可出现下列四种情况:①Na>Mg=Al ②Na=Mg=Al ③Na<Mg=Al ④Na<Mg<Al,下列判断正确的是( )
| A. | 当n(Na)=n(Mg)=n(Al)=1mol时,①成立 | B. | 当n(Na)=n(Mg)=n(Al)=0.8mol时,②成立 | ||
| C. | 当n(Na)=n(Mg)=n(Al)=0.6mol时,③成立 | D. | 当n(Na)=n(Mg)=n(Al)=0.5mol时,④成立 |
13.能证明丙烯分子里含有一个碳碳双键的事实是( )
| A. | 丙烯分子里碳氢原子个数比为1:2 | |
| B. | 丙烯完全燃烧生成的CO2和H2O的物质的量相等 | |
| C. | 丙烯容易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质 | |
| D. | 丙烯能使酸性KMnO4溶液褪色 |
10.通常海水的pH=8.1,在稳定海水pH中起作用的离子是( )
| A. | Na+ | B. | HCO3- | C. | CO32- | D. | Cl- |
7.将30mL一定浓度的硝酸与4.51g铜片反应,当铜片全部反应后,共生成2.24L气体(准标状况).则硝酸的物质的量浓度至少为( )
| A. | 9 mol/L | B. | 8 mol/L | C. | 5 mol/L | D. | 10 mol/L |
8.下列说法正确的是( )
| A. | 将明矾加入海水中静置过滤是海水淡化的方法之一 | |
| B. | 海水晒盐的过程发生复分解反应 | |
| C. | 海水中提取镁的过程不涉及氧化还原反应 | |
| D. | 从海水中提取铀等微量元素是海水资源综合利用研究方向之一 |