题目内容
16.某酸性溶液中加入Ba2+ 后出现白色沉淀,则该溶液中一定含有( )| A. | Fe3+ | B. | SO42- | C. | NO3- | D. | Cl- |
分析 某酸性溶液中加入Ba2+后出现白色沉淀,说明生成的难溶物不溶于酸,选项能够与钡离子反应生成不溶于酸的难溶物的离子为硫酸根离子,据此进行解答.
解答 解:某酸性溶液中加入Ba2+后出现白色沉淀,说明生成的难溶物不溶于酸,选项能够与钡离子反应生成不溶于酸的难溶物的离子为硫酸根离子,所以一定含有SO42-,故选B.
点评 本题考查离子共存的正误判断,属于中等难度的试题,注意明确离子不能大量共存的一般情况:(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间,注意明确常见的难溶物、气体、弱电解质;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
4.某温度下,0.021mol•L-1NaHSO3溶液的pH约为3.下列有关说法中正确的是( )
| A. | c(HSO3-)+2c(SO32-)+c(H2SO3)=0.021mol•L-1 | |
| B. | c(OH-)+c(SO32-)=c(H2SO3)+c(HSO3-) | |
| C. | $\frac{c({H}^{+})•c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$约为5×10-5 | |
| D. | 加水稀释10倍后,溶液的pH=4 |
11.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol Cl2与足量的Fe充分反应,转移电子的数目为3NA | |
| B. | 常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| C. | 常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1 mol ${\;}_{6}^{14}$C原子中所含中子数目为6NA |
1.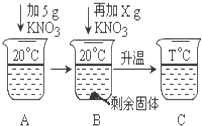 下表是KNO3、NaCl在不同温度下的部分溶解度数据,请回答问题:
下表是KNO3、NaCl在不同温度下的部分溶解度数据,请回答问题:
(1)40℃时,将70gKNO3固体加入100g水中,充分搅拌,形成的溶液质量为163.9g.
(2)60℃时,KNO3的饱和溶液中含有少量NaCl,可通过降温结晶方法获得较纯净的KNO3晶体.
(3)t℃时,NaCl和KNO3的饱和溶液溶质质量分数相同,该温度范围是B.
A.10℃~20℃B.20℃~40℃C.40℃~60℃D.60℃~80℃
(4)向20mL水中溶解一定量KNO3固体的操作如下图:请根据实验现象和溶解度数据回答:A、B、C中溶液一定不饱和溶液的是A.当x=1.32g时,B中恰好没有固体剩余.
 下表是KNO3、NaCl在不同温度下的部分溶解度数据,请回答问题:
下表是KNO3、NaCl在不同温度下的部分溶解度数据,请回答问题:| 温度(℃) | 10 | 20 | 40 | 60 | 80 |
| KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 35.8 | 36 | 36.6 | 37.3 | 38.4 |
(2)60℃时,KNO3的饱和溶液中含有少量NaCl,可通过降温结晶方法获得较纯净的KNO3晶体.
(3)t℃时,NaCl和KNO3的饱和溶液溶质质量分数相同,该温度范围是B.
A.10℃~20℃B.20℃~40℃C.40℃~60℃D.60℃~80℃
(4)向20mL水中溶解一定量KNO3固体的操作如下图:请根据实验现象和溶解度数据回答:A、B、C中溶液一定不饱和溶液的是A.当x=1.32g时,B中恰好没有固体剩余.
8.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 短周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
5.下列实验装置设计正确,且能达到实验目的是( )

| A. | 实验Ⅰ:制备金属钠 | B. | 实验Ⅱ:制取Fe(OH)2并观察其颜色 | ||
| C. | 实验Ⅲ:制取NaAlO2 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
 中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体.请回答下列问题:
中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体.请回答下列问题:
 +2CH2=C(CH3)2→
+2CH2=C(CH3)2→
 .
.