题目内容
5.下列实验装置设计正确,且能达到实验目的是( )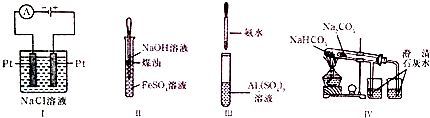
| A. | 实验Ⅰ:制备金属钠 | B. | 实验Ⅱ:制取Fe(OH)2并观察其颜色 | ||
| C. | 实验Ⅲ:制取NaAlO2 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
分析 A.惰性电极电解NaCl溶液,氢离子、氯离子放电;
B.煤油隔绝空气,防止生成的氢氧化亚铁被氧化;
C.氨水不能溶解氢氧化铝;
D.碳酸氢钠不稳定,加热易分解.
解答 解:A.惰性电极电解NaCl溶液,氢离子、氯离子放电,则生成NaOH、氢气、氯气,不能制备Na,故A错误;
B.煤油隔绝空气,防止生成的氢氧化亚铁被氧化,则图中装置可制取Fe(OH)2并观察其颜色,故B正确;
C.氨水不能溶解氢氧化铝,应选强碱NaOH制取NaAlO2,故C错误;
D.碳酸氢钠不稳定,加热易分解,则小试管中应为碳酸氢钠可比较稳定性,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及电解、物质的制备、稳定性比较等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析及实验装置的作用,题目难度不大.

练习册系列答案
相关题目
14.下面有关13C、15N的叙述正确的是( )
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同位素 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
16.某酸性溶液中加入Ba2+ 后出现白色沉淀,则该溶液中一定含有( )
| A. | Fe3+ | B. | SO42- | C. | NO3- | D. | Cl- |
13.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| B. | 将煤气化后再作为能源,可减少PM2.5引起的危害 | |
| C. | 用激光笔分到照射盛有蓝墨水、FeCl3 溶液的玻璃杯均出现光亮的通路 | |
| D. | 氨气液化时能吸收大量的热,常用来做冷冻剂 |
20.酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是( )
| A. | 酯化反应的产物只有酯 | |
| B. | 酯化反应一般需要用NaOH溶液来吸收生成的酯 | |
| C. | 酯化反应是有限度的 | |
| D. | 浓硫酸可做酯化反应的催化剂 |
10.化学与生活密切相关,下列物质用途对应正确的是( )
| A. | 生石灰用作食品抗氧剂 | B. | 氢氧化镁做胃酸中和剂 | ||
| C. | 浓硫酸可刻蚀石英制艺术品 | D. | 明矾做天然水消毒剂 |
17.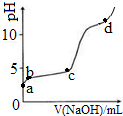 室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列说法正确的是( )
室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列说法正确的是( )
 室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列说法正确的是( )
室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列说法正确的是( )| A. | a点,离子方程式为:Al3++3OH-→Al(OH)3↓ | |
| B. | a~b段,溶液pH增大,促进了氢氧化铝的碱式电离 | |
| C. | b~c段,加入的OH-主要用于生成Al(OH)3沉淀 | |
| D. | d点时,Al(OH)3沉淀开始溶解 |
14.铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2$\stackrel{高温}{→}$2PbO+2SO2;
③制粗铅:PbO+C$\stackrel{高温}{→}$Pb+CO↑;PbO+CO$\stackrel{高温}{→}$Pb+CO2.下列说法正确的是( )
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2$\stackrel{高温}{→}$2PbO+2SO2;
③制粗铅:PbO+C$\stackrel{高温}{→}$Pb+CO↑;PbO+CO$\stackrel{高温}{→}$Pb+CO2.下列说法正确的是( )
| A. | 浮选法富集方铅矿的过程属于化学变化 | |
| B. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| C. | 整个冶炼过程中,制取1 mol Pb共转移2 mol电子 | |
| D. | 将1 mol PbS完全冶炼成Pb理论上至少需要6 g碳 |
15.电视连续剧《大宋提刑官》中的主人公宋慈在案件侦破中常使用“银针验毒”,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列有关说法正确的是( )
| A. | X的化学式为AgS | |
| B. | 银针验毒时,空气中氧气发生氧化反应 | |
| C. | 反应中Ag和H2S均是还原剂 | |
| D. | 每生成1mo1X会转移2mo1电子 |