题目内容
5. 中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体.请回答下列问题:
中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体.请回答下列问题:(1)红褐色胶体中H粒子的直径大小范围1~100nm;
(2)写出D的一种工业用途:耐火材料或电解法制金属铝;
(3)①写出E的酸性溶液与H2O2反应生成F的离子方程式:Fe2++H2O2+2H+═2Fe3++2H2O;
②写出B→G的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑;
③写出E与NaClO和NaOH混合溶液反应生成H的离子方程式:2Fe2++ClO-+4OH-+H2O=2Fe(OH)3↓+Cl-;
(4)若A、B恰好完全反应,将产物C与足量盐酸反应得到a mol气体,另取等质量B与足量盐酸反应得到b mol气体,a:b=5:7,则A的化学式为Fe5O7.
分析 已已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体推断H为Fe(OH)3,C+Cl2→F,判断F为FeCl3,C为Fe,C盐酸反应生成E,E和过氧化氢反应生成F,说明E为FeCl2,转化关系中的B、D都和氢氧化钠反应,且A+B=C+D,判断为A为铁的氧化物,B为Al,D为Al2O3,G为NaAlO2,结合对应物质的性质以及题目要求解答该题.
解答 解:已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体推断H为Fe(OH)3,C+Cl2→F,判断F为FeCl3,C为Fe,C盐酸反应生成E,E和过氧化氢反应生成F,说明E为FeCl2,转化关系中的B、D都和氢氧化钠反应,且A+B=C+D,判断为A为铁的氧化物,B为Al,D为Al2O3,G为NaAlO2,
(1)胶体中分散质的直径介于1~100nm,
故答案为:1~100nm;
(2)D为Al2O3,熔点高,可用与耐高温材料,还可用于冶炼铝,
故答案为:耐火材料或电解法制金属铝;
(3)①E为FeCl2,F为FeCl3,E的酸性溶液与H2O2反应生成F的离子方程式为:Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:Fe2++H2O2+2H+═2Fe3++2H2O;
②B→G的反应为铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
③E与NaClO和NaOH混合溶液反应生成H的离子方程式为2Fe2++ClO-+4OH-+H2O=2Fe(OH)3↓+Cl-,
故答案为:2Fe2++ClO-+4OH-+H2O=2Fe(OH)3↓+Cl-;
(4)A、B恰好完全反应后,将产物铁与足量盐酸反应得到a mol气体,根据转移电子守恒知铁的物质的量=氢气的物质的量=amol,若将反应前的铝与足量NaOH溶液反应,可得到b mol气体,根据转移电子守恒知铝的物质的量=$\frac{2}{3}$bmol,且a:b=5:7,根据转移电子守恒得铁的化合价=$\frac{\frac{2}{3}×b×3}{a}$=$\frac{\frac{2}{3}×7×3}{5}$=2.8,则A的化学式为Fe5O7,
故答案为:Fe5O7.
点评 本题以元素化合物的推断为载体考查了元素化合物的性质,通过元素化合物的推断考查学生的推理、分析、判断等能力,正确推断元素化合物是解本题的关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 铝热反应原理是炼铁最常用的反应原理 | |
| B. | 氧化铝熔点很高,可用作耐火材料 | |
| C. | 过氧化钠可以用作呼吸面具中的供氧剂 | |
| D. | 青铜是我国使用最早的合金 |
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同位素 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
| A. | Fe3+ | B. | SO42- | C. | NO3- | D. | Cl- |
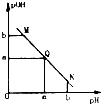 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-1g[OH+])与pH的变化关系如图所示,则
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-1g[OH+])与pH的变化关系如图所示,则 2014年3.15晚会的主题为“让消费更有尊严”,食品行业依旧是消费者最为关注的行业.频发的食品安全事件,让公众几乎患上了“食物焦虑症”.国际环保组织绿色和平发布报告,称对“立顿”的绿茶、茉莉花茶和铁观音袋泡茶检验,发现含有被国家禁止在茶叶上使用的高毒农药灭多威.灭多威是一种白色晶状固体,略具有硫磺的气味,其化学式为C5H10N2O2S.
2014年3.15晚会的主题为“让消费更有尊严”,食品行业依旧是消费者最为关注的行业.频发的食品安全事件,让公众几乎患上了“食物焦虑症”.国际环保组织绿色和平发布报告,称对“立顿”的绿茶、茉莉花茶和铁观音袋泡茶检验,发现含有被国家禁止在茶叶上使用的高毒农药灭多威.灭多威是一种白色晶状固体,略具有硫磺的气味,其化学式为C5H10N2O2S. 自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.