题目内容
8.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 短周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
分析 A.主族元素的最高正化合价等于其最外层电子数(个别元素除外);
B.电子的能量越高,摆脱原子核束缚的能力越强,在离核远的区域运动;
C.过渡元素包含副族元素与第Ⅷ族元素;
D.电子层相同时核电荷数越大半径越小.
解答 解:A.主族元素的最高正化合价等于其最外层电子数(个别元素除外),而副族元素的价电子包含倒数第二层、甚至倒数第三层电子,故A错误;
B.电子的能量越高,摆脱原子核束缚的能力越强,在离核远的区域运动,电子能量越低,在离核较近的区域内运动,故B错误;
C.位于金属和非金属分界线附近的元素,表现一定的金属性与非金属性,而过渡元素包含副族元素与第Ⅷ族元素,故C错误;
D.电子层相同时核电荷数越大半径越小,所以短周期元素(除0族元素外)从左到右,原子半径逐渐减小,故D正确;
故选D.
点评 本题考查结构性质位置关系的应用,难度不大,侧重对基础知识的巩固,A选项为易错点,学生容易只考虑主族元素.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | 甲 | 乙 | 丙 | 实验结论 | 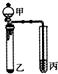 |
| A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:碳>硅 | |
| B | 双氧水 | MnO2 | Na2S | 氧化性:H2O2>O2>S | |
| C | 浓硫酸 | Na2SO3 | 酸性KMnO4溶液 | SO2具有漂白性 | |
| D | 浓氨水 | 氢氧化钠固体 | 酚酞 | 碱性:NaOH>NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
16.某酸性溶液中加入Ba2+ 后出现白色沉淀,则该溶液中一定含有( )
| A. | Fe3+ | B. | SO42- | C. | NO3- | D. | Cl- |
3.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆,原理相似 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 |
13.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| B. | 将煤气化后再作为能源,可减少PM2.5引起的危害 | |
| C. | 用激光笔分到照射盛有蓝墨水、FeCl3 溶液的玻璃杯均出现光亮的通路 | |
| D. | 氨气液化时能吸收大量的热,常用来做冷冻剂 |
20.酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是( )
| A. | 酯化反应的产物只有酯 | |
| B. | 酯化反应一般需要用NaOH溶液来吸收生成的酯 | |
| C. | 酯化反应是有限度的 | |
| D. | 浓硫酸可做酯化反应的催化剂 |
17.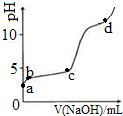 室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列说法正确的是( )
室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列说法正确的是( )
 室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列说法正确的是( )
室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列说法正确的是( )| A. | a点,离子方程式为:Al3++3OH-→Al(OH)3↓ | |
| B. | a~b段,溶液pH增大,促进了氢氧化铝的碱式电离 | |
| C. | b~c段,加入的OH-主要用于生成Al(OH)3沉淀 | |
| D. | d点时,Al(OH)3沉淀开始溶解 |
18.a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示.
请回答:
(l)d属于d区的元素,其基态原子的价电子排布图为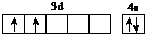 .
.
(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种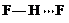 、
、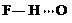 、
、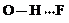 、
、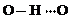 任意一种.
任意一种.
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp3杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$ cm3(NA用表示阿
伏加德罗常数的值).
| a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第4纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
(l)d属于d区的元素,其基态原子的价电子排布图为
 .
.(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种
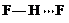 、
、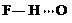 、
、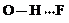 、
、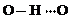 任意一种.
任意一种.(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp3杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$ cm3(NA用表示阿
伏加德罗常数的值).
 自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.