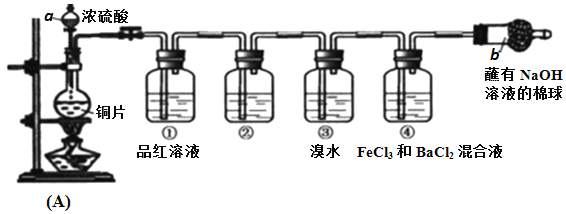
题目内容
【题目】某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
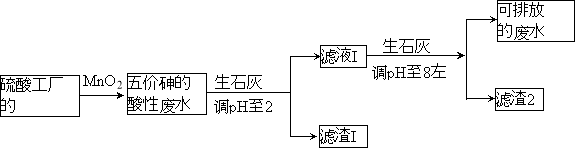
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
难溶物 | Ksp |
Ca3(AsO4)2 | 6.8×10-19 |
CaSO4 | 9.1×10-6 |
FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
污染物 | H2SO4 | As |
废水浓度 | 29.4g/L | 1.6g·L-1 |
排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3= 。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
【答案】(17分)
(1)0.3 (2分)
(2)5.7×10-17(2分)
(3)2H++MnO2+H3AsO3==H3AsO4+Mn2++H2O (3分)
(4)①CaSO4 (2分)
②H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2开始沉淀(3分)[或:pH增大,促进H3AsO4电离,c(AsO43-)增大,Qc=c3(Ca2+)·c2(AsO43-)≥Ksp[Ca3(AsO4)2,Ca3(AsO4)2才沉淀]
③![]() (2分) 2.5×10-3(3分)
(2分) 2.5×10-3(3分)
【解析】
试题分析:(1)读表2中信息,以1L废水为研究对象,其中含有29.4gH2SO4,由于硫酸的相对分子质量为98,m/M=n,则n(H2SO4)=29.4g÷98g/mol=0.3mol,由于c=n/V,则c(H2SO4)=0.3mol÷1L=0.3mol/L;(2)FeAsO4是难溶盐,废水中存在其沉淀溶解平衡:FeAsO4 (s)![]() Fe3++AsO43-,则Ksp(FeAsO4)=c(Fe3+)c(AsO43-),所以c(AsO43-)= Ksp(FeAsO4)/c(Fe3+)=5.7×10-21/1.0×10-4 mol·L-1=5.7×10-17 mol·L-1;(3)H3AsO3失去2个电子被氧化为H3AsO4,MnO2得到2个电子被还原为Mn2+,废水是酸性溶液,根据电子、电荷、原子守恒原理可得:2H++MnO2+H3AsO3==H3AsO4+Mn2++H2O;(4)①由于CaO+2H+==Ca2++H2O,读表1中信息可知,加入生石灰调解pH到2时,增大钙离子浓度,使CaSO4 (s)
Fe3++AsO43-,则Ksp(FeAsO4)=c(Fe3+)c(AsO43-),所以c(AsO43-)= Ksp(FeAsO4)/c(Fe3+)=5.7×10-21/1.0×10-4 mol·L-1=5.7×10-17 mol·L-1;(3)H3AsO3失去2个电子被氧化为H3AsO4,MnO2得到2个电子被还原为Mn2+,废水是酸性溶液,根据电子、电荷、原子守恒原理可得:2H++MnO2+H3AsO3==H3AsO4+Mn2++H2O;(4)①由于CaO+2H+==Ca2++H2O,读表1中信息可知,加入生石灰调解pH到2时,增大钙离子浓度,使CaSO4 (s)![]() Ca2++SO42-的平衡向左移动,析出CaSO4沉淀[加入生石灰调解pH到2时,增大钙离子浓度,使Qc=c(Ca2+)·c(SO42-)≥Ksp[CaSO4),开始析出CaSO4沉淀];②H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2 (s)
Ca2++SO42-的平衡向左移动,析出CaSO4沉淀[加入生石灰调解pH到2时,增大钙离子浓度,使Qc=c(Ca2+)·c(SO42-)≥Ksp[CaSO4),开始析出CaSO4沉淀];②H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2 (s) ![]() 3Ca2++2AsO43-的平衡向左移动,开始析出Ca3(AsO4)2沉淀[或pH增大,促进H3AsO4电离,c(AsO43-)增大,Qc=c3(Ca2+)·c2(AsO43-)≥Ksp[Ca3(AsO4)2,Ca3(AsO4)2才沉淀];③多元弱酸分步电离,则H3AsO4
3Ca2++2AsO43-的平衡向左移动,开始析出Ca3(AsO4)2沉淀[或pH增大,促进H3AsO4电离,c(AsO43-)增大,Qc=c3(Ca2+)·c2(AsO43-)≥Ksp[Ca3(AsO4)2,Ca3(AsO4)2才沉淀];③多元弱酸分步电离,则H3AsO4![]() H++H2AsO4-、H2AsO4-
H++H2AsO4-、H2AsO4-![]() H++HAsO42-、HAsO42-
H++HAsO42-、HAsO42-![]() H++AsO43-,根据平衡常数定义式可得,第三步电离平衡常数K3=[ c(H+) c(AsO43-)]/ c(HAsO42-);水的离子积常数Kw= c(H+) c(OH-),AsO43-+H2O
H++AsO43-,根据平衡常数定义式可得,第三步电离平衡常数K3=[ c(H+) c(AsO43-)]/ c(HAsO42-);水的离子积常数Kw= c(H+) c(OH-),AsO43-+H2O![]() HAsO42-+OH-的平衡常数的计算表达式为[c(HAsO42-)c(OH-)]/ c(AsO43-),分子、分母同时乘以c(H+),则水解平衡常数=[c(HAsO42-)c(OH-) c(H+)]/[ c(H+)c(AsO43-)]= Kw/K3=(1.0×10-14)÷(4.0×10-12)=2.5×10-3。
HAsO42-+OH-的平衡常数的计算表达式为[c(HAsO42-)c(OH-)]/ c(AsO43-),分子、分母同时乘以c(H+),则水解平衡常数=[c(HAsO42-)c(OH-) c(H+)]/[ c(H+)c(AsO43-)]= Kw/K3=(1.0×10-14)÷(4.0×10-12)=2.5×10-3。

 千里马走向假期期末仿真试卷寒假系列答案
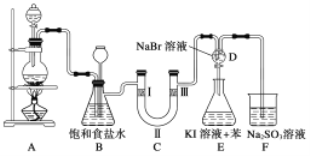
千里马走向假期期末仿真试卷寒假系列答案【题目】下图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程
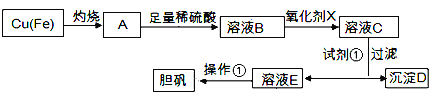
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是________(填字母)。
A. NaClO B. H2O2 C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择________(填化学式)。
(3)操作①的名称是________。
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是________。
A. 将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B. 向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C. 将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D. 向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5) 沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是________________(用离子方程式表示)。