��Ŀ����
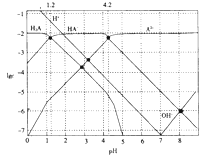
����Ŀ��ȡһ������NaOH��Һͨ��CO2��,�ټ��������Һ����μ���0.1 mol/L������,��״���²�����CO2������������������֮��Ĺ�ϵ����ͼ��ʾ,�����й�˵����ȷ����

A. ԭ��Һ��NaOH�����ʵ���Ϊ0.75 mol
B. ͨ��CO2�����õ���Һ���ʳɷ�ΪNaOH��Na2CO3
C. ͨ��CO2�����õ���Һ�к���2.5��10-3 mol NaHCO3
D. ��������a����ֵΪ224
���𰸡�C
�����������������A��������75mL������ʱ������ﵽ�������ΪNaCl������Ԫ���غ㣬n(NaOH)=n(HCl)=n(NaCl)=75��10��3��0.1mol=7.5��10��3mol���ʴ���B��0��25������������С��25��75���ĵ�������������ΪNa2CO3��NaHCO3���ʴ���C�������ķ�Ӧ��Na2CO3��HCl=NaHCO3��NaCl��NaHCO3��HCl=NaCl��CO2����H2O�����ԭ��Һ��NaHCO3���ʵ���Ϊ��[(75��25)��10��3��0��1��25��10��3��0.1]mol=2.5��10��3mol������ȷ��D������ѡ��C�ķ�����V(CO2)=(75��25)��10��3��0.1��22.4��10��3mL=112mL���ʴ���

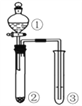
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵ�����Ӧʵ����۵��� ( )
ѡ�� | �� | �� | �� | ʵ����� |
|
A | Ũ���� | Na2SO3 | KMnO4��Һ��ɫ | SO2��Ư���� | |
B | Ũ���� | KMnO4 | FeBr2��Һ��Ϊ��ɫ | �����ԣ�Cl2 >Br2 | |
C | ϡ���� | ̼���� | CaCl2��Һ�����Ա仯 | CO2����CaCl2��Ӧ | |
D | Ũ���� | ���� | ��ˮ��ɫ | Ũ���������ˮ�ԡ���ˮ�� |
A. A B. B C. C D. D