题目内容
8.如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.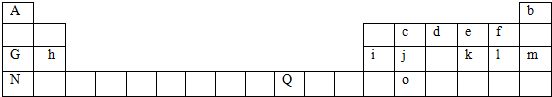
请根据要求用元素符号或化学式回答下列问题:
(1)表中所列元素中,原子最外层有2个电子的元素为He、Mg、Ni.
(2)画出d元素原子的结构示意图
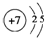 ,其气态氢化物溶于水显碱性.(填“酸”或“碱”)
,其气态氢化物溶于水显碱性.(填“酸”或“碱”)(3)比较元素G和元素h形成的最高价氧化物的水化物的碱性强弱NaOH>Mg(OH)2.
(填写化合物的化学式)
(4)表中j元素在元素周期表中的位置是第三周期ⅣA族,Q元素在元素周期表中的位置是第四周期第Ⅷ族
(5)表中所列元素中,最高价氧化物对应水化物碱性最强的是KOH(填写化合物的化学式,下同),具有两性的是Al(OH)3.最高价氧化物对应水化物酸性最强的是HClO4.
分析 由元素在周期表中位置,可知A为H,b为He、c为C、d为N、e为O、f为F、G为Na、h为Mg、i为Al、j为Si、k为S、l为Cl、m为Ar、N为K、Q为Ni、o为Ge元素.
(1)所列元素中,原子最外层有2个电子的元素为He、Mg、Ni;
(2)N原子核外有2个电子层,K、L层电子数分别为2、5,氨气溶于生成一水合氨,一水合氨电离出铵根离子与氢氧根离子,溶液呈碱性;
(3)金属性越强,最高价氧化物对应水化物的碱性越强;
(4)由位置可知,j元素在元素周期表中的位置是第三周期ⅣA族,Q元素在元素周期表中的位置是第四周期第Ⅷ族;
(5)K的金属性最强,故氢氧化钾碱性最强,氢氧化铝属于两性氢氧化物,高氯酸的酸性最强.
解答 解:由元素在周期表中位置,可知A为氢,b为He、c为C、d为N、e为O、f为F、G为Na、h为Mg、i为Al、j为Si、k为S、l为Cl、m为Ar、N为钾、Q为Ni、o为Ge元素.
(1)所列元素中,原子最外层有2个电子的元素为He、Mg、Ni,
故答案为:He、Mg、Ni;
(2)N原子核外有2个电子层,各层电子数为2、5,原子结构示意图为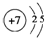 ,氨气溶于生成一水合氨,一水合氨电离出铵根离子与氢氧根离子,溶液呈碱性,
,氨气溶于生成一水合氨,一水合氨电离出铵根离子与氢氧根离子,溶液呈碱性,
故答案为: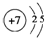 ;碱;
;碱;
(3)金属性Na>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性NaOH>Mg(OH)2,
故答案为:NaOH>Mg(OH)2;
(4)由位置可知,j元素在元素周期表中的位置是第三周期ⅣA族,Q元素在元素周期表中的位置是第四周期第Ⅷ族,
故答案为:第三周期ⅣA族;第四周期第Ⅷ族;
(5)K的金属性最强,故KOH碱性最强,Al(OH)3属于两性氢氧化物,HClO4的酸性最强,
故答案为:KOH;Al(OH)3;HClO4.
点评 本题考查元素周期表与元素周期律,涉及元素周期律、元素周期表结构、原子结构等知识点,知道金属性、非金属性强弱判断方法,题目难度不大.

①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物.
| A. | ③⑤⑥ | B. | ①② | C. | ③⑤ | D. | ①③④ |
| 粒子 | A+ | B2- | C | D | E | F |
| 组成特点 | 单核离子 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
(1)A的元素符号是K,B2-的结构示意图是
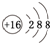 .
.(2)C与D混合,发生反应的化学方程式为F2+2HCl═2HF+Cl2.
(3)E的电子式是
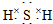 ;F的水溶液常用于消毒剂,F的化学式是H2O2.
;F的水溶液常用于消毒剂,F的化学式是H2O2. | A. | 将工厂的烟囱造高,可提高燃煤的燃烧效率,并可减少工厂周围的大气污染 | |
| B. | 垃圾焚烧法已成为许多城市垃圾处理的主要方法之一,利用垃圾焚烧产生的热能发电或供热,能较充分地利用生活垃圾中的生物质能 | |
| C. | 珍惜地球资源,发展低碳经济,积极开发使用风能、太阳能等新能源,可减少二氧化碳等气体的排放量 | |
| D. | 回收处理废旧电池既可节约金属资源又可减少环境污染,应积极开发废电池的综合利用技术 |
族 周期 | ||||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)②③④三种元素形成的离子中,离子半径由大到小的顺序是K+>Ca2+>Mg2+.
(3)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(4)元素⑦的氢化物的化学式为H2O;该氢化物常温下和②单质反应的化学方程式是2K+2H2O=2KOH+H2↑;若该氢化物和元素⑧的单质反应,则化学方程式为Cl2+H2O=HCl+HClO.
(5)⑨的最高价氧化物对应水化物的化学式为HBrO4;①和⑨两元素形成化合物为NaBr;该化合物灼烧时火焰颜色为黄色;该化合物的溶液与元素⑧的单质反应的离子方程式为2Br-+Cl2═2Cl-+Br2.
(6)①和⑤元素最高价氧化物对应水化物相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
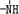 、
、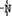 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-.
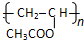 .
.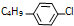 ,则R有4种.
,则R有4种.