题目内容
17.乙炔为原料在不同条件下可以合成多种有机物.
已知:①CH2=CH-OH(不稳定)→CH2CHO
②一定条件下,醇与酯会发生交换反应:
RCOOR′+R″OH$\stackrel{一定条件}{→}$RCOOR″+R′OH完成下列填空:
(1)写出反应类型:③取代反应;④加成反应.
反应⑤的反应条件催化剂.
(2)写出B生成C反应化学方程式2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH;写出②反应化学方程式nCH3COOCH=CH2$\stackrel{催化剂}{→}$
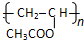 .
.(3)R是M的同系物,其化学式为
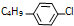 ,则R有4种.
,则R有4种.(4)写出含碳碳双键、能发生银镜反应且属于酯的D的所有同分异构体的结构简式HCOOCH2CH=CH2;HCOOCH=CHCH3(顺反);HCOOC(CH3)=CH2.
分析 乙炔和水发生加成反应生成B,根据信息①知,B为CH3CHO,B被氧化生成C,C为CH3COOH,乙炔和乙酸反应生成D,根据D分子式知,乙炔和乙酸发生加成反应生成D,D能发生加聚反应,则D中含有碳碳双键,则D结构简式为CH2=CHCH2COOH,E结构简式为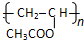 ,E和甲醇发生取代反应生成乙酸甲酯和尿不湿;
,E和甲醇发生取代反应生成乙酸甲酯和尿不湿;
根据反应⑤知,C6H6为苯,苯和丙烯发生反应加成反应生成F,F发生取代反应生成M,则F为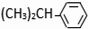 ,据此分析解答.
,据此分析解答.
解答 解:乙炔和水发生加成反应生成B,根据信息①知,B为CH3CHO,B被氧化生成C,C为CH3COOH,乙炔和乙酸反应生成D,根据D分子式知,乙炔和乙酸发生加成反应生成D,D能发生加聚反应,则D中含有碳碳双键,则D结构简式为CH2=CHCH2COOH,E结构简式为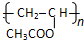 ,E和甲醇发生取代反应生成乙酸甲酯和尿不湿;
,E和甲醇发生取代反应生成乙酸甲酯和尿不湿;
根据反应⑤知,C6H6为苯,苯和丙烯发生反应加成反应生成F,F发生取代反应生成M,则F为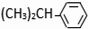 ,
,
(1)通过以上分析知:③是取代反应;④加成反应,反应⑤是取代反应,需要的反应条件催化剂,故答案为:取代;加成;催化剂;
(2)B发生氧化反应生成C,B生成C反应化学方程式2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH;E发生加聚反应生成E,所以②反应化学方程式nCH3COOCH=CH2$\stackrel{催化剂}{→}$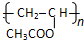 ,
,
故答案为:2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH;nCH3COOCH=CH2$\stackrel{催化剂}{→}$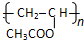 ;
;
(3)R是M的同系物,其化学式为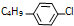 ,丁基有四种同分异构体,所以R有4种,
,丁基有四种同分异构体,所以R有4种,
故答案为:4;
(4)D结构简式为CH2=CHCH2COOH,D的同分异构体中含碳碳双键、能发生银镜反应且属于酯,符合条件的同分异构体结构简式为HCOOCH2CH=CH2、HCOOCH=CHCH3(顺反)、HCOOC(CH3)=CH2,
故答案为:HCOOCH2CH=CH2;HCOOCH=CHCH3(顺反);HCOOC(CH3)=CH2.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及获取信息利用信息解答问题能力,熟悉常见有机物官能团及其性质、反应条件是解本题关键,注意题给信息的灵活运用,题目难度不大.


(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为NH4NO3、NH3•H2O、HNO3,相同浓度上述水溶液中由水电离出的c(H+)最小的是HNO3(填写化学式).
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式4NH3+12OH--12e-=2N2+12H2O,溶液中OH-向负极移动(填“正”或“负”).
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快.
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole-转移,该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.
②将铜粉末用10%甲和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
③实验室可用甲作试剂取X的单质,发生装置可选用图2中的C(填装置代号).
 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.已知:C(s)+O2(g)?CO2(g)△H=-393kJ•mol-1;
2CO (g)+O2(g)?2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO (g)+H2(g)△H=+132 kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.8mol/(L•min).
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注.
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,
还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 $\frac{\underline{\;通电\;}}{\;}$2CO+O2,若阳
极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3.
| A. | 陶瓷、玻璃和水泥都是无机非金属材料;青铜、碳素钢和石英都是合金 | |
| B. | 油脂皂化和蛋白质水解都是由高分子生成小分子的过程 | |
| C. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 | |
| D. | 食盐可作调味剂,也可作食品防腐剂;福尔马林可作食品的保鲜剂 |
| A. | 共价键都具有方向性 | |
| B. | σ键是镜像对称,而π键是轴对称 | |
| C. | π键是由两个p电子“肩并肩”重叠形成的 | |
| D. | σ键 都是由两个p轨道“头碰头”重叠形成的 |
| A. | NH4HCO3═NH3↑+CO2↑+H2O | B. | NH3+HCl=NH4Cl | ||
| C. | 2KOH+Cl2=KCl+KClO+H2O | D. | 2K2O2+2CO2=2K2CO3+O2 |
| A. | 2Na2O2+2H2O═4NaOH | |
| B. | 2S+3O2═2SO3 | |
| C. | 3NO2+2H2O═3HNO3 | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
 ,其气态氢化物溶于水显碱性.(填“酸”或“碱”)
,其气态氢化物溶于水显碱性.(填“酸”或“碱”)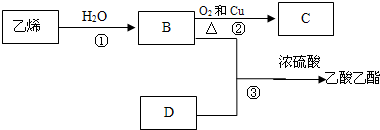
 .
.