题目内容
7.取标准状况下CH4和过量O2的混合气体896mL点燃,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0.800g,若将点燃后的气体用过量浓硫酸吸收,则浓硫酸增重0.36g.计算:(1)碱石灰吸收后所剩气体的体积(标准状况下).
(2)原混合气体中CH4与O2的体积比.
分析 (1)已知混合气体896mL,碱石灰增重0.800g为二氧化碳、水的质量,根据方程式算参加反应气体的物质的量,然后求出反应的气体的体积,进而计算剩余气体的体积.
(2)由CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$ CO2+2H2O可知,反应中甲烷的体积为反应的总体积的$\frac{1}{3}$,再根据总体积求出原来氧气的体积,进而求出体积比.
解答 解:(1)已知混合气体896mL,则其总物质的量n=$\frac{V}{Vm}$=$\frac{0.896L}{22.4L/mol}$=0.04mol,
由题知0.800g为生成CO2与H2O的总质量,
CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$ CO2+2H2O
3mol (44g+36g)=80g
nmol 0.800g
n=$\frac{3mol×0.800g}{80g}$=0.03mol,
则参加反应的气体为V=nVm=0.03mol×22.4L/mol=0.672L=672mL,
所以碱石灰吸收后所剩气体的体积为896mL-672mL=224mL;
答:碱石灰吸收后所剩气体的体积为224mL;
(2)CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$ CO2+2H2O可知,反应中甲烷为$\frac{1}{3}$,则V(CH4)=672mL×$\frac{1}{3}$=448mL,
所以氧气的总体积为896mL-448mL=448mL,
则原混合气体中CH4与O2的体积比448:448=1:1;
答:原混合气体中CH4与O2的体积比为1:1.
点评 本题考查混合物计算,关键是利用质量守恒定律确定参加反应氧气与甲烷总质量,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案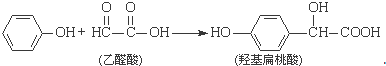
| A. | 该反应是取代反应 | |
| B. | 苯酚和羟基扁桃酸不是同系物 | |
| C. | 乙醛酸能使酸性KMnO4溶液褪色 | |
| D. | 1 mol羟基扁桃酸能与2 mol NaOH反应 |
| A. | 稀硝酸与CuO反应 | B. | 稀硝酸与NaOH 溶液反应 | ||
| C. | 浓硝酸与灼热的碳反应 | D. | 浓硝酸与铜反应 |
| A. | X的分解速率与Y的消耗速率相等 | |
| B. | X、Y与Z的物质的量之比为2:1:1 | |
| C. | 混合气体的密度不再变化 | |
| D. | 单位时间内生成lmolY的同时分解1mol X |
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②二氧化硫和氯气均能使品红溶液褪色
③二氧化硫能使品红溶液和溴水褪色
④溴化氢和碘化氢气体均不能用浓硫酸干燥
⑤浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字.
| A. | 只有②③④ | B. | 只有④ | C. | 只有③④ | D. | 全部 |
| A. | 1mol氯气参加氧化还原反应,转移的电子数一定为2 NA | |
| B. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,44g二氧化碳分子中所形成的共用电子对数为2 NA | |
| D. | 常温常压下,1.6gO2和O3混合气体中质子总数为0.8NA |
 .
. ,结构式为H-O-H.
,结构式为H-O-H.