题目内容
【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。在一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol-1)的变化。

(1)该反应为___(填吸热或放热)反应。
(2)在体积固定的密闭容器中,下列能说明该反应已经达到平衡状态的是___(填序号)。
A.v(H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH)
D.容器内气体密度保持不变
E.2molC=O键断裂的同时CH3OH中有1molH—O键形成
F.混合气体的平均摩尔质量不变
(3)在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=___。达平衡时容器内平衡时与起始时的压强比___。
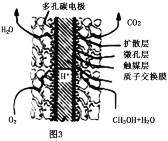
(4)甲醇、氧气在一定条件下可构成如图3所示的燃料电池,其负极的电极反应为___,与铅蓄电池相比,当消耗相同质量的负极物质时,甲醇燃料电池的理论放电量是铅蓄电池的___倍(保留小数点后1位)。
【答案】放热 BCF 0.225mol/(L·min) 5∶8 CH3OH-6e-+H2O=6H++CO2 19.4
【解析】
(1)根据反应物的总能量大于生成物的总能量判断;
(2)根据化学平衡的特征分析判断;
(3)根据三段式结合物质的量比等于压强比计算解答;
(4)甲醇、氧气在酸性条件下可构成燃料电池,负极上甲醇失去电子生成二氧化碳;铅蓄电池中负极材料为Pb,氧化为PbSO4,结合转移的电子数计算甲醇燃料电池的理论放电量与铅蓄电池的倍数。
(1)由图可知,该反应中反应物的总能量大于生成物的总能量,则该反应为放热反应,故答案为:放热;
(2)A.v(H2)=3v(CO2),始终存在,不能判断正、逆反应速率的关系,不能判定平衡状态,故A错误;B.该反应为气体物质的量变化的反应,容器内气体的压强为变量,则容器内气体压强保持不变,说明达到平衡状态,故B正确;C.v逆(CO2)=v正(CH3OH),可知正、逆反应速率相等,说明达到平衡状态,故C正确;D.混合气体的质量、体积不变,则容器内气体密度始终保持不变,不能判定平衡状态,故D错误;E.1molH-O键断裂的同时2molC=O键形成,都表示正反应速率,不能判定平衡状态,故E错误;F.反应前后气体的物质的量发生变化,则混合气体的平均摩尔质量为变量,混合气体的平均摩尔质量不变,说明达到平衡状态,故F正确,故答案为:BCF;
(3)根据三段式:

从反应开始到平衡,用氢气浓度变化表示的平均反应速率为:v(H2)=![]() =0.225mol/(L·min);达平衡时容器内平衡时与起始时的压强之比为
=0.225mol/(L·min);达平衡时容器内平衡时与起始时的压强之比为![]() =5∶8,故答案为:0.225mol/(L·min); 5∶8;
=5∶8,故答案为:0.225mol/(L·min); 5∶8;
(4)甲醇、氧气在酸性条件下可构成燃料电池,负极上甲醇发生氧化反应生成二氧化碳,负极的电极反应式为CH3OH-6e-+H2O=6H++CO2;铅蓄电池中负极材料为Pb,氧化为PbSO4,甲醇燃料电池中负极通入甲醇,氧化生成CO2,相同质量的Pb和甲醇转移的电子数之比为![]() ×2∶
×2∶![]() ×6=32∶621,则甲醇燃料电池的理论放电量是铅蓄电池的
×6=32∶621,则甲醇燃料电池的理论放电量是铅蓄电池的![]() 倍=19.4倍,故答案为:CH3OH-6e-+H2O=6H++CO2;19.4。
倍=19.4倍,故答案为:CH3OH-6e-+H2O=6H++CO2;19.4。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案

