题目内容
【题目】雾霾中含有多种污染物,包括氮氧化物![]() 、CO、
、CO、![]() 等。它们可以通过化学反应得到一定的消除或转化。
等。它们可以通过化学反应得到一定的消除或转化。
![]() 氮硫的氧化物的转化:
氮硫的氧化物的转化: ![]()
已知:![]()
![]()
![]() ,则
,则![]() _______
_______![]() 。
。
一定条件下,将![]() 与
与![]() 以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有_______。
以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有_______。
![]() 混合气体的密度不变
混合气体的密度不变 ![]() 混合气体的颜色保持不变
混合气体的颜色保持不变
![]() 和NO的体积比保持不变
和NO的体积比保持不变 ![]() 反应速率
反应速率![]()
![]() 碳氧化物的转化:
碳氧化物的转化:
![]() 可用于合成甲醇,反应方程式为:
可用于合成甲醇,反应方程式为:![]() ,在一恒温恒容密闭容器中充入
,在一恒温恒容密闭容器中充入![]() 和
和![]() 进行上述反应。测得CO和
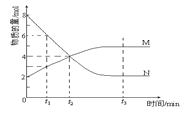
进行上述反应。测得CO和![]() 浓度随时间变化如图1所示。
浓度随时间变化如图1所示。

则![]() 内,氢气的反应速率为____
内,氢气的反应速率为____![]() 第
第![]() 后,保持温度不变,向该密闭容器中再充入
后,保持温度不变,向该密闭容器中再充入![]() 和
和![]() ,则平衡_______
,则平衡_______![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 移动。
移动。
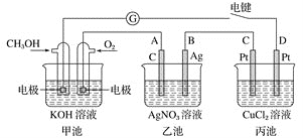
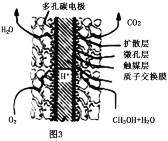
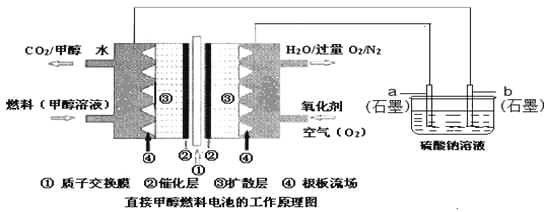
![]() 通过电解CO制备
通过电解CO制备![]() ,电解液为碳酸钠溶液,工作原理如图2所示,写出阴极的电极反应式_____。若以甲醇燃料电池作为电源,则生成标准状况下
,电解液为碳酸钠溶液,工作原理如图2所示,写出阴极的电极反应式_____。若以甲醇燃料电池作为电源,则生成标准状况下![]() 需要消耗
需要消耗![]() 的质量为_______。
的质量为_______。

![]() 硫氧化物的转化:硫的氧化物与一定量氨气、空气反应,可生成硫酸铵。硫酸铵水溶液呈酸性的原因是________________
硫氧化物的转化:硫的氧化物与一定量氨气、空气反应,可生成硫酸铵。硫酸铵水溶液呈酸性的原因是________________![]() 用离子方程式表示
用离子方程式表示![]() 室温时,向
室温时,向![]() 溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系:
溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系:![]() ____
____![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
【答案】![]() b
b ![]() 正向
正向 ![]()
![]()
![]()
![]()
【解析】
根据盖斯定律及热化学方程式书写规则计算反应热并书写热化学方程式;根据化学平衡原理分析是否达到化学平衡状态;根据题给信息计算反应速率,根据Q与K的相对大小判断平衡的移动方向;根据电解原理及电极反应式进行相关计算;根据物料守恒及电荷守恒比较溶液中的离子浓度大小。
![]() 由盖斯定律可知,
由盖斯定律可知,![]() 得出反应
得出反应![]() ,所以
,所以![]() ,
,
![]() 反应体系的体积和质量都不变,所以混合气体的密度不变不能说明反应达到平衡状态;
反应体系的体积和质量都不变,所以混合气体的密度不变不能说明反应达到平衡状态;
![]() 颜色的深浅与
颜色的深浅与![]() 的浓度有关系,所以当混合气体的颜色保持不变时,则说明
的浓度有关系,所以当混合气体的颜色保持不变时,则说明![]() 的浓度不再发生变化,因此反应达到平衡状态;
的浓度不再发生变化,因此反应达到平衡状态;
![]() 若
若![]() 和NO以物质的量之比
和NO以物质的量之比![]() 充入容器中,无论是否达到平衡状态,
充入容器中,无论是否达到平衡状态,![]() 和NO的体积比始终保持不变,不能说明反应达到平衡状态;
和NO的体积比始终保持不变,不能说明反应达到平衡状态;
![]() 无论是否达到平衡状态,化学反应速率之比都等于化学计量数之比,不能说明反应达到平衡状态;故答案为:
无论是否达到平衡状态,化学反应速率之比都等于化学计量数之比,不能说明反应达到平衡状态;故答案为:![]() ;b;
;b;
![]() ①生成
①生成![]() 甲醇,需要消耗
甲醇,需要消耗![]() 氢气,所以前4min内
氢气,所以前4min内![]() ;
;![]() ,4min后,保持温度不变,向该闭容器中再充入
,4min后,保持温度不变,向该闭容器中再充入![]() 和
和![]() ,
,![]() ,所以反应向正反应方向进行,故答案为:
,所以反应向正反应方向进行,故答案为:![]() ;正向;
;正向;
②电解原理可知,阳极失去电子生成二氧化碳气体,加入碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,阴极CO得到电子生成甲烷气体,据此离子反应方程式为:![]() ,阴极区电极反应式为
,阴极区电极反应式为![]() ;电解CO制备
;电解CO制备![]() ,C元素的化合价由
,C元素的化合价由![]() 价降低到
价降低到![]() 价,发生还原反应,电解质为碳酸钠溶液,则阴极区电极反应式为
价,发生还原反应,电解质为碳酸钠溶液,则阴极区电极反应式为![]() ;甲醇燃料电池中,每消耗
;甲醇燃料电池中,每消耗![]() ,转移
,转移![]() ,标准状况下,
,标准状况下,![]() 的物质的量为
的物质的量为![]() ,生成
,生成![]() 转移的电子数为
转移的电子数为![]() ,则需要甲醇为
,则需要甲醇为![]() ,质量为
,质量为![]() ;故答案为:
;故答案为:![]() ;
;![]() ;
;
![]() 硫酸铵是强酸弱碱盐,其水溶液呈酸性的原因是
硫酸铵是强酸弱碱盐,其水溶液呈酸性的原因是![]() 水解使溶液显酸性:
水解使溶液显酸性:![]() ;室温时,向
;室温时,向![]() 溶液中滴入NaOH溶液至溶液呈中性,根据电荷守恒,
溶液中滴入NaOH溶液至溶液呈中性,根据电荷守恒,![]() ,中性溶液中
,中性溶液中![]() ,物料守恒为
,物料守恒为![]() ,则所得溶液中
,则所得溶液中![]() ;故答案为:
;故答案为:![]() ;
;![]() 。
。

 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案