题目内容
【题目】焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶,其性质活泼,具有强还原性,是常用的食品抗氧化剂之一。制备该物质的反应方程式为: Na2SO3+SO2= Na2S2O5,某研究小组利用该反应在实验室制备焦亚硫酸钠并探究其有关性质。请回答下列问题:
(1)采用下图装置制取Na2S2O5,装置Ⅲ中有Na2S2O5晶体析出。
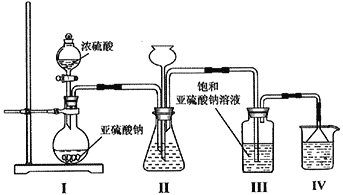
①装置Ⅰ中盛放浓硫酸的仪器名称为__________;滴加浓硫酸前需要将装置內的空气排净,这样操作的目的是___________________________________。
②装置Ⅱ的作用之一是观察SO2的生成速率,其中的液体最好选择____________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
③从装置Ⅲ中分离出Na2S2O5晶体可采取的操作方法是_______________;裝置Ⅳ的作用是_________________________,盛装的试剂为_____________________。
(2)将0.5mol Na2S2O5溶于水配成1L溶液,测得该溶液pH=4.5,溶液中部分微粒浓度随溶液酸碱性变化的情况如图所示。
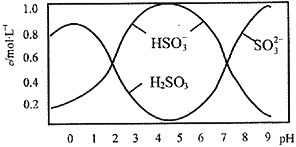
①写出上述条件下Na2S2O5溶解于水时与水反应的化学方程式_____________________;
②结合溶液中的离子平衡的知识解释溶液显酸性的原因_____________________________。
(3)检验Na2S2O5晶体在空气中已被氧化的实验方案是_________________________。
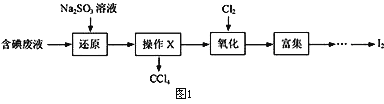
(4)葡萄酒常用Na2S2O5作抗氧化剂,葡萄酒中抗氧化剂的残留量通常是以游离SO2的含量计算,我国国家标准(GB2760—2014) 规定葡萄酒中SO2的残留量≤0.25g/L。该研究小组测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算) 的方案如下:
![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
按上述方案进行实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量为___g·L-1,该数据说明某葡萄酒中SO2的残留量_________ (填“是”或“否”)达到我国国家标准。
【答案】 分液漏斗 防止产品被空气中的氧气氧化 c 过滤 处理尾气,防止空气污染 NaOH 溶液 Na2S2O5+H2O=2NaHSO3 溶液中HSO3-的电离程度大于其水解程度 取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成 0.128 是
【解析】(1)①装置Ⅰ中盛放浓硫酸的仪器名称为分液漏斗;因焦亚硫酸钠具有强还原性,防止其产品被空气中的氧气氧化,故滴加浓硫酸前需要将装置內的空气排净;②装置Ⅱ的作用之一是观察SO2的生成速率,即所选择的液体不能与二氧化硫反应,最好选择c;③装置Ⅲ中饱和亚硫酸钠溶液与二氧化硫反应生成焦亚硫酸钠晶体,故分离出Na2S2O5晶体可采取的操作方法是过滤;裝置Ⅳ的作用是吸收多余的二氧化硫,防止污染环境,故应盛装NaOH溶液;(2)①Na2S2O5溶于水,测得该溶液pH=4.5,根据图像可知,溶液中主要微粒为HSO3—,即:Na2S2O5+H2O=2NaHSO3;②因溶液中HSO3-既能电离,又能水解,其电离程度大于其水解程度,导致溶液显酸性;(3)若Na2S2O5晶体在空气中已被氧化,则应该生成Na2SO4,通过检验样品中是否含有SO42-,即取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成,证明Na2S2O5晶体在空气中已被氧化;(4)根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量
=![]() =0.128g/L;该数据说明某葡萄酒中SO2的残留量是达到我国国家标准。
=0.128g/L;该数据说明某葡萄酒中SO2的残留量是达到我国国家标准。

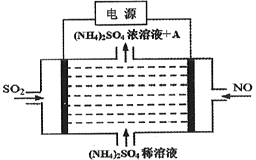
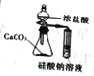
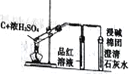
【题目】下列实验装置正确且能达到实验目的的是
A | B | C | D | |
实验目的 | 比较盐酸、碳酸、硅酸的酸性强弱 | 检验碳与浓H2SO4反应的产物中含CO2 | 验证铁的析氢腐蚀 | 模拟电解精炼铜 |
实验装置 |
|
|
|
|
A. A B. B C. C D. D