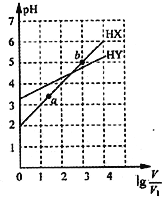
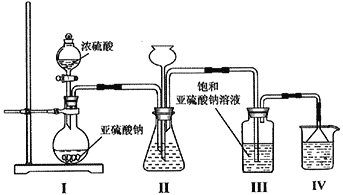
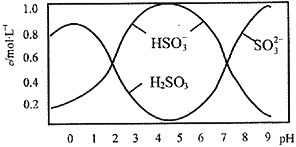
题目内容
【题目】已知Ksp[AgCl]=1.8×10-10,Ksp[AgBr]=4.9× 10-13,Ksp[AgI]=1.0×10-16,Ksp[Ag2S]=1.6×10-49。则除去NaNO3溶液中混有的AgNO3,所用下列试剂中效果最好的是
A. NaC1溶液 B. NaBr 溶液 C. NaI溶液 D. Na2S溶液
【答案】D
【解析】由已知AgCl、AgBr、AgI的Ksp可得,AgI更难溶,所以要除去NaNO3溶液中混有的AgNO3,所用下列试剂A、B、C三项中,C项NaI溶液效果更好;因为AgI和Ag2S中阴阳离子个数比不相等,所以不能直接通过Ksp来判断AgI与Ag2S谁更难溶,需通过计算:AgI饱和溶液中,c(I-)×c(Ag+)=Ksp[AgI],即c2(I-)=1.0×10-16,所以c(I-)=1.0×10-8;Ag2S饱和溶液中,Ag2S![]() 2Ag++S2-,c(S2-)×c2(Ag+)=Ksp[Ag2S],即c(S2-)×[2c(S2-)]2=1.6×10-49,所以c(S2-)=
2Ag++S2-,c(S2-)×c2(Ag+)=Ksp[Ag2S],即c(S2-)×[2c(S2-)]2=1.6×10-49,所以c(S2-)=![]() ;因为
;因为![]() <1.0×10-8,所以Ag2S比AgI更难溶,则除去NaNO3溶液中混有的AgNO3,用Na2S溶液效果最好,故选D。
<1.0×10-8,所以Ag2S比AgI更难溶,则除去NaNO3溶液中混有的AgNO3,用Na2S溶液效果最好,故选D。

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目