题目内容
16. X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | 原子半径:W>Z>X | |
| B. | 非金属性:Z>Y | |
| C. | 最高化合价:Z>X | |
| D. | 最高价氧化物对应水化物的酸性:W>Z |
分析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素,结合元素性质的递变规律分析解答.
解答 解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Z>W>X,故A错误;
B.同主族元素从上到下非金属性减弱,则非金属性Y>Z,故B错误;
C.Z的最高正化合价为+6,X的最高正化合价为+5,故C正确;
D.同周期从左到右元素的非金属性增强,则非金属性W>Z,非金属性越强,最高价氧化物对应水化物的酸性越强,所以W的最高价氧化物对应水化物的酸性比Z的强,故D正确,
故选CD.
点评 本题考查位置结构性质的应用,Y是推断的突破口,侧重对元素周期律的考查,注意对元素周期律的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.已知下述三个实验中的物质均能发生化学反应.
下列判断正确的是( )
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 实验③中反应的离子方程式为Fe+Fe3+═2Fe2+ | |
| C. | 实验②中Fe2+既显氧化性又显还原性 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
7.金属钠久置空气中发生变质,欲证明所得固体中既含有NaOH又含有Na2CO3,可以选择的操作步骤有:
①固体溶解
②过滤
③加入过量BaCl2溶液
④加入过量CuCl2溶液
⑤加入足量盐酸
⑥滴加无色酚酞试液.你认为最可行的方案是( )
①固体溶解
②过滤
③加入过量BaCl2溶液
④加入过量CuCl2溶液
⑤加入足量盐酸
⑥滴加无色酚酞试液.你认为最可行的方案是( )
| A. | ①③②⑤ | B. | ①④②⑤ | C. | ①③②⑥ | D. | ①⑥⑤ |
4.下列是有关外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是( )


| A. | ①是其他条件一定时,反应速率随温度变化的图象,则正反应△H>0 | |
| B. | ②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图象 | |
| C. | ③是在有无催化剂存在条件下,建立平衡过程的图象,a是使用催化剂时的曲线 | |
| D. | ④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图象 |
11.全部由第三周期元素形成的化合物是( )
| A. | HF | B. | NO | C. | Na2S | D. | MgF2 |
5.下列有关能源的说法不正确的是( )
| A. | 人类利用能源的三个阶段分别是:柴草时期、化石能源时期、多能源结构时期 | |
| B. | 人类使用沼气是对化学能的充分利用 | |
| C. | 海底有大量的天然气水合物-“可燃冰”,它是一种比较洁净的能源 | |
| D. | 生物质能主要指用树木、庄稼、草类等植物直接或间接提供的能量,它是不可再生的能源 |
16.用下列实验装置能达到所述的实验目的是( )
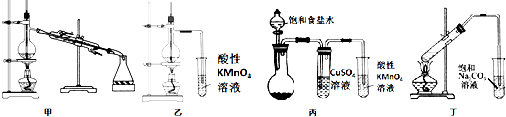

| A. | 利用装置甲既可以进行石油的分馏,也可以进行酒精的浓缩 | |
| B. | 利用装置乙可以完成实验室制备乙烯气体并检验乙烯气体的生成 | |
| C. | 利用装置丙可以完成实验室制备乙炔气体并检验乙炔气体的生成 | |
| D. | 利用装置丁可以完成实验室制备乙酸乙酯并收集较为纯净的乙酸乙酯 |