题目内容
16.用下列实验装置能达到所述的实验目的是( )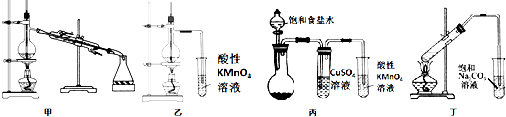
| A. | 利用装置甲既可以进行石油的分馏,也可以进行酒精的浓缩 | |
| B. | 利用装置乙可以完成实验室制备乙烯气体并检验乙烯气体的生成 | |
| C. | 利用装置丙可以完成实验室制备乙炔气体并检验乙炔气体的生成 | |
| D. | 利用装置丁可以完成实验室制备乙酸乙酯并收集较为纯净的乙酸乙酯 |
分析 A.蒸馏时温度计用于测量馏分的温度;
B.检验乙烯,应排出乙醇的影响;
C.饱和食盐水和碳化钙反应生成乙炔,硫酸铜可除去硫化氢、磷化氢等杂质,酸性高锰酸钾可检验乙炔;
D.制备乙酸乙酯时应防止倒吸.
解答 解:A.蒸馏时温度计应位于蒸馏烧瓶的支管口,用于测量馏分的温度,故A错误;
B.制备乙烯时,因乙醇易挥发,则乙烯中混有乙醇,可被酸性高锰酸钾氧化,则检验乙烯,应排出乙醇的影响,应先除杂,故B错误;
C.饱和食盐水和碳化钙反应生成乙炔,硫酸铜可除去硫化氢、磷化氢等杂质,乙炔可被酸性高锰酸钾氧化,则酸性高锰酸钾可检验乙炔,故C正确;
D.乙酸乙酯中混有乙醇、乙酸,乙醇易溶于水,乙酸与碳酸钠反应,则制备乙酸乙酯时应防止倒吸,导管不能插入液面以下,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体收集、物质制备及分离与提纯等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
16. X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | 原子半径:W>Z>X | |
| B. | 非金属性:Z>Y | |
| C. | 最高化合价:Z>X | |
| D. | 最高价氧化物对应水化物的酸性:W>Z |
11.25℃时,水中存在电离平衡:H2O?H++OH-,下列关于水的说法正确的是( )
| A. | 水的电离是吸热过程,升高温度不利于电离 | |
| B. | 向水中加入少量稀硫酸,水的离子积KW不变 | |
| C. | 含H+的溶液显酸性,含OH-的溶液显碱性 | |
| D. | 向水中加入少量氢氧化钠溶液,水的电离程度变大 |
8.某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:试管、胶头滴管.
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在下表横线中填写相关内容):
(4)实验结论:同一主族,自上而下,元素的非金属性依次减弱.
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-═2Cl-+Br2、Br2+2I-═2Br-+I2.
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举两项事实说明氟的非金属性比氯强:F2在冷暗处就可以与H2剧烈反应而爆炸,而Cl2与H2要在光照或点燃时才反应、HF比HCl更稳定.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:试管、胶头滴管.
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在下表横线中填写相关内容):
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙色 |
| ② | 向盛有少量碘化钾溶液的试管中滴加少量溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫色 |
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-═2Cl-+Br2、Br2+2I-═2Br-+I2.
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举两项事实说明氟的非金属性比氯强:F2在冷暗处就可以与H2剧烈反应而爆炸,而Cl2与H2要在光照或点燃时才反应、HF比HCl更稳定.
5.下列行为中,可行的是( )
| A. | 进入煤矿井时,用火把照明 | |
| B. | 用点燃的火柴在液化气钢瓶旁检验钢瓶是否漏气 | |
| C. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| D. | 某地化工厂的贮藏罐肆意外发生泄漏,有关方面紧急组织群众沿逆风方向疏散 |
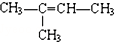
 .
.