题目内容
20.某化学兴趣小组模拟肾脏功能,采用间接电化学方法使代谢产物中的尿素CO(NH2)2被氧化成CO2和N2而除去,原理如图1所示:
(1)质子交换膜将电解池分为阴极区和阳极区两部分,阴极区产生的气体为H2;电解过程中该区域溶液的pH不变(填“变大”、“变小”或“不变”).
(2)阳极区发生的反应依次为2Cl--2e-═Cl2↑、CO(NH2)2+3Cl2+H2O=CO2+N2+6HCl.
(3)若实验中共除去尿素3.6g,则两极共收集到标况下的气体6.72L (忽略气体的溶解).
(4)在没有直流电源时可以用新型甲烷燃料电池(如图2)做“模拟肾脏”的电源,使用时电池M极与电解池B极(填“A”或“B”)相连;请写出电池负极反应的方程式CH4+10OH--8e-=CO32-+7H2O.
(5)已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.3kJ/mol
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol
则甲烷燃烧生成液态水的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol.
分析 (1)阴极区为氢离子得电子发生还原反应,阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑),阳极首先发生氧化反应生成氯气,氯气和尿素反应生成氮气、二氧化碳和氯化氢,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,据此判断阴极区溶液的pH变化;
(2)阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
(3)根据电极方程式计算,有关反应有为阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑),阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
(4)用新型甲烷燃料电池做“模拟肾脏”的电源,甲烷为负极发生失电子的氧化反应,与之相连的为阴极;
(5)①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.3kJ/mol
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol
根据盖斯定律①+②+③×2得到.
解答 解:(1)阴极区为氢离子得电子发生还原反应,阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑),阳极首先发生氧化反应生成氯气,氯气和尿素反应生成氮气、二氧化碳和氯化氢,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变,故答案为:H2;不变;
(2)阳极首先发生氧化反应生成氯气,氯气和尿素反应生成氮气、二氧化碳和氯化氢,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,故答案为:CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
(3)阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑)
阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.
根据方程式CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl消耗尿素3.6g即$\frac{3.6}{60}$=0.06mol,可知生成0.06molN2和0.06molCO2,转移0.06×6=0.36mole-时,所以阴极产生0.18molH2,故电解共收集到的0.06+0.06+0.18=0.3mol气体,则两极共收集到标况下的气体0.3×22.4=6.72L,故答案为:6.72;
(4)用新型甲烷燃料电池做“模拟肾脏”的电源,甲烷为负极发生失电子的氧化反应,因为碱性电解质,所以反应式为:CH4+10OH--8e-=CO32-+7H2O;与甲烷M极相连的为阴极,所以使用时电池M极与电解池B极相连,故答案为:B;CH4+10OH--8e-=CO32-+7H2O;
(5)①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.3kJ/mol
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol
根据盖斯定律①+②+③×2得到CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-571.6+247.3-283.0×2=-890.3 kJ/mol,故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol.
点评 本题考查了盖斯定律及其电解原理知识,包括电极产物的判断、电解原理及其应用等,解答电解原理试题时,首先要注意阳极材料,若阳极材料为除Au、Pt之外的金属,则阳极金属先失去电子,若阳极材料为惰性电极,则考虑阴离子的放电顺序,熟记阴阳离子的放电顺序是解题的关键.

 阅读快车系列答案
阅读快车系列答案| A. | 乙烯与溴化氢制溴乙烷与苯与溴反应制溴苯 | |
| B. | 蛋白质水解生成氨基酸与淀粉发酵生成酒精 | |
| C. | 乙醇脱水制乙烯与乙醇、乙酸脱水制乙酸乙酯 | |
| D. | 甲烷和氯气制一氯甲烷与苯和硝酸反应制硝基苯 |
| A. | 盐 | B. | 氧化物 | C. | 含氧酸 | D. | 混合物 |
| A. | CH4+3Cl2$\stackrel{光照}{→}$CHCl3+3HCl(取代反应) | |
| B. | nH2C=CHCl→ (缩聚反应) (缩聚反应) | |
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O(氧化反应) | |
| D. | CH3COOH+CH3OH$→_{△}^{浓硫酸}$CH3COOCH3+H2O(消去反应) |

| A. | 1mol该有机物最多可以和5mol NaOH反应 | |
| B. | 该有机物容易发生加成、取代、中和、消去等反应 | |
| C. | 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 | |
| D. | 1mol该有机物与浓溴水或氢气反应,最多消耗3mol Br2或6molH2 |
| 甲 | |
| 乙 | 丙 |
| A. | 原子半径:甲<乙 | |
| B. | 最外层电子数:甲>乙 | |
| C. | 最高价氧化物对应的水化物的碱性:丙>乙 | |
| D. | 金属性:丙<乙 |
 (其中R为饱和烃基),在一定条件下发生如图所示转化关系:
(其中R为饱和烃基),在一定条件下发生如图所示转化关系:
 或
或 .
. .
.
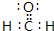 ,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为平面三角形.
,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为平面三角形.