题目内容
13.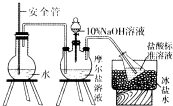 硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.
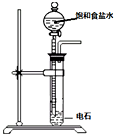
硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.①NH4+含量测定:称取9.8g硫酸亚铁铵晶体,加适量水溶解,注人如图所示的三颈瓶中,然后逐滴加人足量lO%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用lOOmL 1.0mol•L-1的盐酸标准溶液吸收.
蒸氨结束后取下接收瓶,用1.0mol•L-1NaOH标准溶液滴定剩余的HCl,到终点时消耗50mlNaOH溶液.
②Fe2+含量测定:向上述实验后的三颈瓶中加入过量的3%的双氧水,充分反应后过滤、洗涤、灼烧得到2.0 g固体.
③结晶水含量测定:称取9.8g硫酸亚铁铵晶体,在质量为15g的坩埚中加热至200℃,恒温一段时间,置于空气中冷却,称量质量为22.3g;重复上述加热、冷却、称量过程,发现两次称量结果相同.回答下列问题:
(1)装置中安全管的作用原理是当三颈烧瓶中压力过大时,安全管中液面上升,使三颈烧瓶瓶中压力稳定.
(2)冰盐水的作用是防止盐酸挥发.
(3)用NaOH标准溶液滴定剩余的HCl时,可使用的指示剂是甲基橙或酚酞.
(4)测定Fe2+时.加人双氧水发生反应的化学方程式是2Fe(OH)2+H2O2=2Fe(OH)3.
(5)如果在测定NH4+含量的过程中,亚铁元素部分被氧化,对Fe2+含量的测定无(填“有”或“无”)影响.
(6)根据①、②的数据,该摩尔盐晶体中n(NH4+):n(Fe2+):n(SO42- )=2:1:2,z=6.
(7)根据③的数据,发现结晶水含量测定结果偏低.从实验过程分析,可能原因是无水固体在空气中冷却时吸收了空气中水蒸气.
分析 (1)三颈烧瓶与圆底烧瓶连通,能平衡三颈烧瓶中的压强;
(2)温度低能防止盐酸挥发;
(3)强碱滴定强酸可以用甲基橙或酚酞作指示剂;
(4)加双氧水,Fe(OH)2被氧化为Fe(OH)3;
(5)亚铁离子后面也要氧化为三价铁;
(6)根据滴定盐酸消耗的氢氧化钠求出与氨气反应的盐酸物质的量以及氨气的物质的量;根据铁元素守恒计算亚铁离子的物质的量;n(SO42- )=$\frac{1}{2}$n(NH4+)+n(Fe2+);由题给数据可知根据物质的量之比求算z.
(7)由③中数据可知m(H2O)=9.8g+15g-22.3g=2.5g,结晶水含量测定结果偏低,在空气中冷却时固体会吸水.
解答 解:(1)三颈烧瓶与圆底烧瓶连通,当三颈烧瓶中压力过大时,安全管中液面上升,使三颈烧瓶瓶中压力稳定;
故答案为:当三颈烧瓶中压力过大时,安全管中液面上升,使三颈烧瓶瓶中压力稳定;
(2)冰盐水温度较低,用于冷却锥形瓶中的盐酸标准溶液,防止盐酸挥发,故答案为:防止盐酸挥发;
(3)强碱滴定强酸可以用甲基橙或酚酞作指示剂,所以用NaOH标准溶液滴定剩余的HCl时,可以使用甲基橙或酚酞作指示剂,故答案为:甲基橙或酚酞;
(4)加双氧水,Fe(OH)2被氧化为Fe(OH)3,其反应的方程式为:2Fe(OH)2+H2O2=2Fe(OH)3,故答案为:2Fe(OH)2+H2O2=2Fe(OH)3;
(5)测定Fe2+的含量,是把Fe2+转化为氢氧化铁,再灼烧得到氧化铁,根据铁元素守恒计算,所以在测定NH4+含量的过程中,亚铁元素部分被氧化,对Fe2+含量的测定无影响,故答案为:无;
(6)用1.0mol•L-1NaOH标准溶液滴定剩余的HCl,到终点时消耗50mlNaOH溶液,则盐酸的物质的量n(HCl)=n(NaOH)=1.0mol•L-1×0.05L=0.05mol,
与氨气反应的盐酸为1.0mol•L-1×0.1L-0.05mol=0.05mol,所以氨气的物质的量为0.05mol,则n(NH4+)=0.05mol;
n(Fe2+)=2n(Fe2O3)=2×$\frac{2g}{160g/mol}$=0.025mol,n(SO42- )=$\frac{1}{2}$n(NH4+)+n(Fe2+)=$\frac{1}{2}$×0.05mol+0.025mol=0.05mol,
所以n(NH4+):n(Fe2+):n(SO42- )=0.05mol:0.025mol:0.05mol=2:1:2;
由题给数据可知9.8g摩尔盐中m(H2O)=9.8g-m(NH4+)-m(Fe2+)-m(SO42-)=9.8g-18×0.05g-56×0.025g-96×0.05g=2.7g,
则n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,所以$\frac{z}{2}$=$\frac{0.15}{0.05}$,解得z=6;
故答案为:2:1:2;6;
(7)由③中数据可知m(H2O)=9.8g+15g-22.3g=2.5g,由①②计算得到的水的质量为2.7g,结晶水含量测定结果偏低,因为固体在坩埚中加热后,在空气中冷却时固体会吸水,导致剩余固体的质量偏大,则求出的水的质量偏小;
故答案为:无水固体在空气中冷却时吸收了空气中水蒸气.
点评 本题考查物质的含量测定、中和滴定实验原理的应用、铁的化合物的性质,侧重于学生的分析能力、计算能力和实验能力的考查,题目难度中等,注意把握相关实验基本方法和注意事项.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案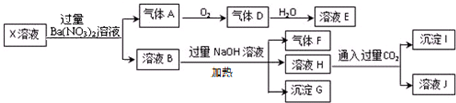
| A. | X中肯定存在Fe2+、A13+、NH4+、C1- | |
| B. | X中不能确定的离子是 K+和C1- | |
| C. | 沉淀G在空气中放置过程中,沉淀颜色会由白色变为灰绿色最后变为红褐色 | |
| D. | 标准状况下将一试管D气体倒扣在水槽中充分吸收(假设所得溶液没有扩散),所得溶液物质的量浓度约为0.036mol/L |

| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3mol离子 |
| A. | 铝需经过特别处理才具有抗腐蚀能力 | |
| B. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| C. | Li是最轻的金属也是活动性很强的金属,是制造电池的理想物质 | |
| D. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 |
| A. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 2.0g重水(2H2O)中含有的质子数为1.0 NA | |
| C. | 标准状况下,11.2 LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA | |
| D. | 标准状况下,2.24LSO3中含有的O原子的数目为0.3NA |
| A. | 煤油 | B. | 水. | C. | 汽油 | D. | 四氯化碳 |
| A. | 分散质粒子的直径小于1nm | B. | 都是红褐色 | ||
| C. | 都有丁达尔效应 | D. | 都比较稳定 |
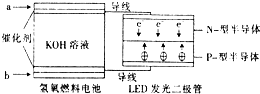 LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )
LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )| A. | a处通入氢气,发生还原反应 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | 该装置中只涉及两种形式的能量转化 | |
| D. | P-型半导体连接的是电池负极 |