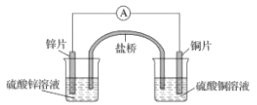
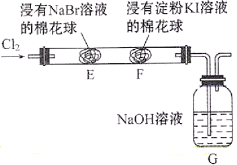
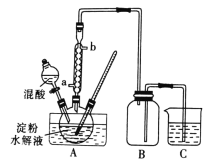
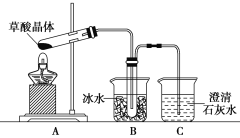
题目内容
【题目】一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O=MnOOH+OH-,下列说法正确的是

A.铝电极上的电极反应式:Al-3e-=Al3+
B.电池工作时,NH4+移向石墨电极
C.每消耗2.7g铝就会有0.3mol电子通过溶液转移到正极上
D.放电过程中正极附近溶液的pH减小
【答案】B
【解析】
A.铝电极上的Al失电子,与碱性溶液(氨水)反应生成氢氧化铝沉淀,电极反应式:Al-3e-+3NH3H2O=Al(OH)3↓+3NH4+,A错误;
B.电池工作时,NH4+向电池的正极移动,即移向石墨电极,B正确;
C.每消耗2.7g铝就会有0.3mol电子通过导线转移到正极上,C错误;
D.根据题给信息分析,放电过程中正极附近OH-浓度增大,溶液的pH增大,D错误;
答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含![]() 等)制备
等)制备![]() 的流程如图所示。
的流程如图所示。

已知:Ⅰ在酸性条件下,![]() 能将
能将![]() 还原为
还原为![]()
Ⅱ. ![]() 的氧化性强于
的氧化性强于![]()
Ⅲ. 相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| 4.9 | 6.8 |
| 1.5 | 2.8 |
回答下列问题:
(1)向含铬废水中加入![]() 调节
调节![]() ,目的是__________。
,目的是__________。
(2)写出“氧化”步骤中反应的例子方程式_________。
(3)“加热”操作的目的是________。
(4)“酸化”过程中发生反应![]()
![]() 已知,“酸化”后溶液中
已知,“酸化”后溶液中![]() 则溶液中
则溶液中![]() =________。
=________。
(5)“结晶”后得到![]() 产品0.3000g,将其溶解后用稀
产品0.3000g,将其溶解后用稀![]() 酸化,再由浓度为
酸化,再由浓度为![]() 标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
(6)在![]() 存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
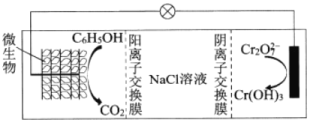
①负极的电极反应式为_________;
②处理过程中,需严格控制正极附近的pH,理由是_________